Скоростта на химическа реакция
Да се говори за осъществимостта на процеса може да бъде промяна на енергийната Gibssa система. Въпреки това, тази стойност не отразява реалната възможност на реакцията му курс и механизма.
За пълния представителството на химическа реакция, е необходимо да има познания за какви са времевите модели в неговото изпълнение, т.е. скоростта на химична реакция и подробно механизъм. Скорост и реакция механизъм за изучаване химична кинетика - изучаване на химичния процес.
От гледна точка на химична кинетика, реакцията може да бъде класифицирана в прости и сложни.
Обикновено реакционните - процеси, които се случват без образуването на междинни съединения. Броят на частици, които участват в това, те са разделени на unimolecular, бимолекулярен, тримолекулен. Collision по-голяма от 3 брой частици е малко вероятно, обаче тримолекулен реакция достатъчно редки и chetyrehmolekulyarnye - неизвестен. Комплекс реакции - процеси, състоящи се от няколко елементарни реакции.
Всеки процес протича с обичайната си скорост, която може да се определя от измененията, които настъпват в продължение на период от време. химическа реакция висока скорост, изразена чрез промяна на броя N на консумираната вещество или вещества, получени за единица обем V за единица време тон.
Ако веществото се консумира, а след това ще се постави знак "-", ако се съхранява - "+"
При постоянен обем:
Единица скорост на реакцията мол / л · S
Като цяло, V - постоянна и не зависи от това дали, за всеки от реагентите, ние следваме.
Зависимостта на концентрацията на реагент или продукт на времето на реакцията са под формата на кинетичната крива. който има формата:
Υ изчисли от експериментални данни е по-удобно, ако по-горе израз, за да се превърнат в следния израз:
υ = - Ас / АТ [мол / л · сек]

Законът за действие на масата. Поръчка и скорост на реакция константа
Една от формите на закона за действието на масите е както следва: Скорост елементарен хомогенна химична реакция е пряко пропорционална на продукта от концентрации на реагентите.
Ако процесът на тест е представен като:
и А + В = B Продукти
скоростта на химична реакция може да бъде изразена от кинетичната уравнение:
А и В - стехиометрични коефициенти на проста реакция,
K - постоянна скорост.
Химически смисъл на количество к - е скоростта на реакцията на отделните концентрации. Това означава, че ако концентрацията на вещества А и В са равни на 1, след това υ = к.
Трябва да се има предвид, че в сложни химически процеси и коефициентите и б не съвпадат със стехиометрично.
Законът за действие на масата се извършва при определени условия:
- Termichno реакция е активиран, т.е. топлинна енергия на молекулите.
- Концентрацията на реагентите е равномерно разпределена.
- Имоти и условията на околната среда не се променят по време на процеса.
- медийна собственост не трябва да бъдат засегнати от к.
По сложните процеси на закона за действието на масите не може да се приложи. Това може да се обясни с факта, че по-сложен процес, състоящ се от няколко елементарни стъпки, и неговата скорост ще бъде не определя от общата стойност на всички етапи на скоростта, само един от най-бавния етап, който се нарича ограничаване на скоростта.
Всяка реакция има своя цел. Определяне частен (частичен) за на реагента и общата (цялата) ред. Например, по отношение на скорост химична реакция за процеса
и А + В = B Продукти
а - за по реагент А
Обикновени методи за реда реакция показва броя на взаимодействие видове (същите стехиометрични съотношения) и е цяло число. За сложни процеси за на реакцията не съвпада с стехиометрични коефициенти и може да бъде всеки.
Определяне на факторите, които влияят на скоростта на химична реакция υ а.
Зависимост на скоростта на реакция на концентрацията на реагентите
Очевидно е, че с увеличаване на концентрациите на реагентите, υ се увеличава увеличава броя на сблъсъци между участващите в химичен процес вещества. Освен това е важно да се вземе предвид реда на реакцията: ако п = 1 за някои реагенти, неговата скорост е директно пропорционална на концентрацията на веществото. Ако някоя реагент п = 2. удвояването на концентрацията ще увеличи скоростта на реакцията в 2 2 = 4 пъти, и увеличаване на концентрацията на 3 пъти, за да се ускори реакцията 3 Февруари = 9 пъти.
Зависимост на скоростта на реакция на налягането
определя Clapeyron - Менделеев. който се отнася концентрацията и налягането:
Следователно, промяната в концентрация в системата, и по този начин скоростта на реакцията е в пряка зависимост от промяната на налягането. Тази връзка се отнася главно до процесите, които протичат с участието на газове. Например, за реакция от първи порядък, увеличението на налягане ще доведе до увеличение на 2-кратно в концентрация на веществото е 2 пъти, че непременно променят υ - ще бъде 2 пъти повече.
Zavisimostskorosti reaktsiiot площ
Що се отнася до хетерогенни реакции. Вещества реагират бързо, ако площта на повърхността, върху която реакцията вещества могат да се появят повече. Разтварянето вещество, ние намаляване размерите на размерите на молекулата, което води до повишаване на повърхностната площ. Следователно химични процеси между субстанции в разтвори, течно или газообразно състояние имат по-голяма скорост от взаимодействието между твърдите вещества.Zavisimostskorosti reaktsiiot природата на веществото.
Е важно структура на електрони обвивка на атома, тип химична връзка и неговото съдържание в структурата на молекулите на веществото, силата му на кристалната решетка. Известно е, че натриев е активно реагира с вода, отколкото, например, калай. Следователно, скоростта на реакцията с калай натриев вода взаимодействие висока скорост вода.Зависимостта от скоростта на реакцията на температурата
определена от принципите на Van't Hoff и Арениус уравнение. Чрез повишаване на температурата, се докладват допълнителни енергийни молекули (увеличават по този начин активиране на енергия), което насърчава реакцията. Сванте Арениус през 1889 г. изследване на зависимостта на υ на температурата, установи, че по-голямата част от химически процеси са обект на уравнението:
където К - константа на скорост на реакцията
Да е енергията на активиране - минимум (критичен) енергията, необходима за блока за реакция е J / мол
Т - абсолютна температура
R - константа газ, R = 8314 J / мол · ° С
А - предварително експоненциален коефициент (коефициент на честота) единица съвпада с к. Тази константа изразява вероятността сблъсък на молекулите са ориентирани така, че взаимодействието е възможно.
Това често се случва, че константата на скоростта е известно в една температура Т1. и когато к е необходимо да се намери някои различна температура Т2. Това е лесно да се направи, ако вземем логаритъм от уравнението на Арениус на Т1 и Т2:
Изваждайки второто уравнение от първи, получаваме:
При определяне на степента на химическа реакция, може да се използва Арениус уравнение (ако ню захранващия уравнение е описано):
Ако приемем, че концентрацията на вещества А и Б са постоянни и логаритми този израз, получаваме следното:
Също така е подходящо да се използва правилото, че е формулиран Jacob Van't Hoff. повишаване на температурата на всеки 10 градуса, води до увеличаване на скоростта на реакцията е от 2 - 4 пъти. Правилото е математически израз:
γ - температурен коефициент, със стойности, вариращи от 2 до 4.
υT1 / υT2 = 03 Февруари = 9. Това означава, че υ увеличава с 9 пъти.
Зависимост на скоростта на реакцията на присъствието на катализатор
Катализ - е всяка промяна в скоростта на реакцията под влиянието на катализатор. Тя може да бъде положителен или отрицателен. Същността на катализ - генериране активни субстрат или реагенти, включващи катализатори.
Катализатор е вещество, което селективно се ускорява химична реакция, като по този начин захващане на междинен етап, но regeniriruyas си край (по време на образуването на крайните продукти). Например, в биохимични среда ензимите действат като катализатори.
Ако такова вещество забавя химическа реакция, тя се нарича инхибитор.
Ефект на катализатора на скорост на реакцията се основава на факта, че той променя активиране енергия EA, или активиране на енергия понижаване A. под действието на катализатора е представена схематично по-долу:
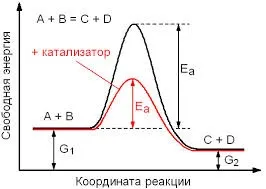
Очевидно е, че веществата А и Б изисква голямо количество енергия, за да образуват крайните продукти. Но в присъствието на катализатор за производство на крайни продукти като изисква много по-малко енергия, тъй като е понижаване на общия активиране енергия и по този начин да се увеличи скоростта на реакцията. Аз привлека вниманието ви към факта, че енергията на двете началната и крайната вещества са едни и същи и в двете реакции.