Оксид и калциев хидроксид
Урок посветена на изучаването на вещества, които са от голямо практическо значение в живота на човека, а именно в тази област на живота си, тъй като строителството. Мастър каже за методи на получаване, свойства и приложения на калциев оксид и хидроксид.
Тема: Материали и тяхната трансформация
Урок оксид и калциев хидроксид. Свойства и приложения
1. Методи за получаване на калциев оксид
Още в древността хората са забелязали, че ако горят варовик, креда или мрамор, на бял прах се получава със специални свойства. Основният компонент на креда, варовик и мрамор е вещество, наречено калциев карбонат. Нейната химична формула - CaCO3. При печене варовика реакция настъпва, уравнението е:
СаСО3 = СаО + CO2

Фиг. 1. минерали, които се основават на калциев карбонат
Калциев оксид може да бъде получена чрез директно изгаряне на калций в кислородна атмосфера:
Когато тази реакция се появява калциев съединение с кислород, за да се образува калциев оксид.
2. исторически имена оксид и калциев хидроксид на
Свойствата на получения калциев оксид се използва в строителството досега. Калциев оксид - СаО е номенклатури връзка. В допълнение към номенклатурата, това вещество има редица исторически имена. Както вече знаете, калциев окис може да се получи чрез изпичане на варовик, така че един от нейните исторически имена - изгорял вар.
Ако в резултат на калциевия оксид, добавете вода, водата ще подсвирне, сякаш грееха. Ето защо, изгорени вар се нарича "негасена вар". При контакт с вода на калциевия оксид, както се прекъсва, като топлина. Затова процес, който се нарича мястото, закаляване и калциев оксид - вар.
Създадена през парата охладителната разрохква негасена вар, тя се натрупва като пух. В тази връзка, в резултат на контакт с вода гасена вар е станал известен като пух.
3. Свойства на калциев оксид
Какво се случва, когато гасене на негасена вар? Установено е, че една молекула на калциев оксид реагира с се формира една молекула вода и само едно ново вещество - гасена вар. Тази реакция е вид връзка.
СаО + H2O = Са (ОН) 2
Формула на гасена вар обикновено се записва, както следва: Са (ОН) 2. Номенклатури на вещество - калциев хидроксид:
4. Използване на оксид и калциев хидроксид в строителството
Сместа на гасена вар и вода се нарича разтвора, който се използва в строителството. Тъй като калциев хидроксид е умерено разтворим във вода, разтвора съдържа утайка от калциев хидроксид и подходящо решение (варно мляко).
Използването хоросан в изграждането на трайни камъни връзка поради втвърдяване във въздуха.
По този начин, на целия процес на получаване и използване на калциев оксид може да бъде представен като съединение (Фиг.2).
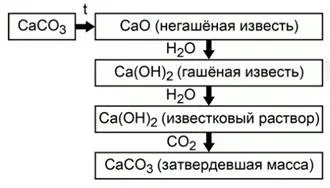
Фиг. 2. Получаване и прилагане на калциев оксид
Калциниране на калциев карбонат се образува гасена вар - калциев оксид. При смесване с вода на калциевия оксид се превръща в гасена вар - калциев хидроксид. Смес от умерено разтворим калциев хидроксид и вода се нарича хоросан. При престояване на въздуха вар суспензия взаимодейства с въглероден диоксид и отново се превръща в калциев карбонат.
Реакция уравнение, съответстващ на процеса на втвърдяване на хоросан:
Са (ОН) 2 + CO2 = СаСО3 + H2O
Втвърдяването на хоросан е така, защото образуваната неразтворима субстанция - калциев карбонат.
Списъкът на препоръчителна четене
1. оксид и калциев хидроксид.
2. неорганична химия.
Зарежда.
Вие трябва да изтеглите учебните планове на тема "оксид и калциевия хидроксид. Свойства и приложения. Hold връзка
Зарежда.
Известни произведения
- Пейзажи в текста на S.Pushkina
- Анализ Blok стихотворение "В областта Kulikovom"
- Баща и син в историята Г. Олдридж "The Last Inch"
- Живота и творчеството на Гьоте VI
- Решенията на арбитражния съд. задачи
- Проектиране кетъринг дизайн закусвалня. част 2
- А. и S. S.Pushkin A.Esenin на руски характер
-
Статистика проекта