Третичната структура на протеина
Това пространствено подреждане α-спирала полипептидна верига или в триизмерна структура (структура). Формата на третичната структура на протеини е разделена на кълбовидни (сферична) и влакнест (нишковидни).
Облигации, които стабилизират третичната структура са оформени между страничните аминокиселинни радикали и техните функционални групи. Връзки могат да бъдат силно (ковалентна) и слаб (полярен и ван дер Ваалс).
Хидрофобна (ван дер Ваалс), йонни и водородни връзки са слаби, но тъй като те се повтаря много пъти в протеин, който играе важна роля в образуването на третичната структура.
При полагане на третичната структура на α-спирала, или полипептидна верига на протеина има тенденция да стане енергично (термодинамично) изгодна форма, характеризиращ се с енергия минимум свободен. В тази връзка радикали хидрофобни аминокиселини, като се избягва форма вода ван дер Ваалс връзки в молекулата на протеин и хидрофилните групи на аминокиселини се намират в близост до външната повърхност и се свързват с вода. В центъра на протеин глобули на практика няма вода, и хидрат обвивка се образува на повърхността си.
При полагане на третичен α-спирала структура придобива известна форма в триизмерното пространство (фиг. 5).
Фиг. Схема 5. Пространствено
Сферичен протеин структура
Видове връзки, участващи в образуването на третичната структура на протеина (фиг. 6).
- хидрофобна връзка (ван дер Ваалс) - се образува между хидрофобния (неполярен) амино радикали;
- водородни връзки - са образувани между полярни радикали незаредени аминокиселини;
- йонен или електростатични връзки - са образувани между полярни заредени аминокиселинни остатъци.
Силни връзки (ковалентни).
- дисулфидна връзка - се образува между двете цистеинови молекулите
- псевдопептид (lozhnopeptidnaya) връзка - е образувана между карбоксилната група на една амино радикал и амино радикал с друга амино киселина;
- естерна връзка - се образува между хидроксилната група на серин или треонин и карбоксилни радикали на глутаминова и аспартамова киселини.
През последното десетилетие, учените са открили, че в клетката има специализирани протеини и ензими, протеини, които регулират процеса на сгъване на новосинтезирани полипептидни вериги в правилния роден третичната структура. Те включват:
- peptdil ензим-пролил-цис / транс изомераза - води до образуване на цис-конформация на пептидната връзка, образувана от азотния атом на пролин, което причинява въртене на полипептидната верига от около 180 (на мястото на редовността на полипептидна верига на α-спиралата е счупен);
- proteindisulfidizomeraza ензим - катализирано разцепване неправилно образува дисулфидни връзки и образува нови S-S-връзки, характеристиката на нативния белтък.
- придружители и chaperonins - каталитично неактивни протеини (открита L.Ellis) - "група протеини," помощ правилното нековалентни монтаж на триизмерна структура на протеина и да се предотврати образуването на функционално неактивни протеинови структури. Синтез чаперони рязко увеличава с излагане температура стрес, така че те се наричат "протеини на топлинния шок". Chaperones държат новосинтезирано полипептидната верига на рибозомата в разгърнато състояние, и chaperonins осигуряват условията за формиране на правилна само третичната структура на протеина.
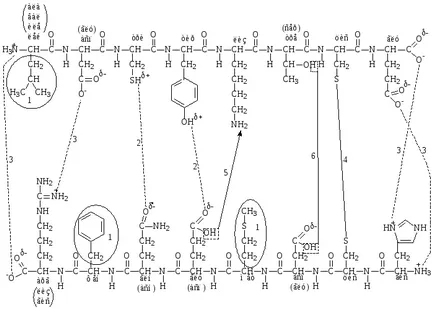
Фиг. 6. контакт участва в образуването на третичната структура на протеина