сярна киселина
Нето 100% сярна киселина (монохидрат) е безцветна маслообразна течност, се втвърдява в кристална маса при 10 ° С Реактивен сярна киселина има плътност обикновено 1.84 гр / cm3 и съдържа около 95% H 2SO 4. То се втвърдява само под -20 ° С
Точка на топене монохидрат е 10,37 ° С при топлина на топене 10,5 кДж / мол. При нормални условия, е много вискозна течност с много висока диелектрична константа (е = 100 при 25 ° С). Незначителни сайт монохидрат електролитни дисоциация протича успоредно по два начина: [H3 SO4 +] · [NSO4 -] = 2 х 10 -4 и [H3 О +] · [NS2 О7 -] = 4 х 10 -5. Неговата молекулен йон състав може да бъде приблизително описано от следните данни (в%):
99,5 0,18 0,14 0,09 0,05 0,04
При добавяне на дори малки количества вода става доминираща схема дисоциация: Н 2О + H 2SO 4 <==> H 3 О + + NSO4 -
H2 SO4 - силен двукиселинно.
Първият етап (за среда концентрация) води до 100% дисоциация:
1) Реакция с метали:
а) разредена сярна киселина се разтваря само метали, стоящи в електрохимичната серия от ляво на водород:
б) концентрирана Н2 6 SO4 - силен окислител; чрез реакция с метали (с изключение на Au, Pt) може да се намали до 4 S О2. S 0 или Н2 S -2 (без нагряване, нито реагира Fe, Al, Cr - пасивирана)
2) концентрирана Н2 S 6 O4 взаимодейства при нагряване с някои неметали поради силното си окислителни свойства, се превръща в сяра съединение с по-ниска степен на окисление (например, S 4 О2):
3) с основни оксиди:
CuO + 2Н + -> Си2 + + Н 2О
2Н + + Cu (OH) 2 -> Си2 + + 2Н 2О
5) обменни реакции със соли:
Образуването на бяло BaSO 4 утайка (неразтворимата в киселина), използвани за идентифициране на сярна киселина и разтворими сулфати.
Монохидрат (чист, 100% сярна киселина) е йонизиращо разтворител като киселинен характер. В него са лесно разтворими сулфати на много метали (като по този начин преминава в бисулфат), докато други соли на киселина се разтварят, обикновено само ако тяхното възможно солволиза (с превръщане бисулфат). Азотна киселина се държи като слаб osnovanieHNO3 монохидрат + 2 H 2SO 4 <==> H3 О + + NO2 + + 2 HSO4 - белина - както много слаб kislotaH2 SO4 + НСЮ4 = H3 SO4 + + СЮ4 - флуоросулфонова киселина и хлоросулфонова са малко по-силен (HSO3 F> HSO3 Cl> НСЮ4). Монохидрат лесно се разтваря много органични вещества с атома в своята структура с несподелени електронни двойки (протон способен на присъединяване). Някои от тях може да бъде разпределена обратно към непроменен държавата, като просто разреждане на разтвора с вода. Монохидрат има висока стойност cryoscopic константи (6,12 °), и те понякога се използва като средство за определяне на молекулно тегло.
Концентрирана H 2SO 4 е доста силно оксидиращо средство, особено при нагряване (общо до възстановен SO2). Например, частично окислява НВг и HI (но не HCl) за свободен халоген. това и много метали окислява - Cu, Hg и т.н. (а злато и платина по отношение на H 2SO 4 устойчив) .. Тъй като взаимодействието с мед идва от уравнението:
Като действа като оксидант, обикновено сярна киселина се редуцира до SO2. Въпреки това, най-силно това намаляване може да бъде намалена до S и Н2 S. Тъй като дори сероводород концентрирана сярна киселина реагира съгласно уравнението:
Трябва да се отбележи, че също така е частично възстановяване на водороден газ и следователно не може да се използва за неговото изсушаване.
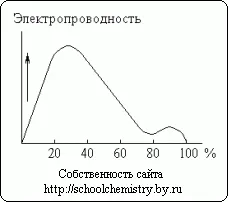
Фиг. 13. електропроводимостта на разтвори на сярна киселина.
Разтварянето на концентрирана сярна киселина във вода се придружава от значително отделяне на топлина (и някои намаляване на общия обем система). Монохидрат едва провежда електрически ток. За разлика от водните разтвори на сярна киселина са добри проводници. Както се вижда на фиг. 13, максимална проводимост има приблизително 30% киселина. Минимална крива съответства на състава на хидрат H 2SO 4 · Н2 О.
Загрява се при разтваряне на монохидрат във вода възлиза на (в зависимост от крайната концентрация на разтвора) за 84 кДж / мол H 2SO 4. Обратно, чрез смесване на 66% сярна киселина, предварително охладен до 0 ° С, и сняг (1: 1 по тегло) може да бъде постигнато чрез намаляване на температурата до -37 ° С
(.% От теглото) Промяна на плътността на водни разтвори на H 2SO 4 с концентрация е дадена по-долу:
Както може да се види от тези данни, определянето на плътността на концентрация на сярна киселина над 90 тегл. % Става много неточни. налягането на водната пара-горе решения H 2SO 4 за различни концентрации при различни температури е показана на Фиг. 15. Сушилня съгласно сярна киселина може да действа само докато налягането на водната пара над неговата разтвор е по-малко от частичното налягане на изсушения газ.
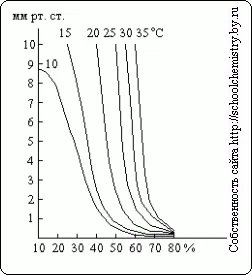
Фиг. 15. пара под налягане.
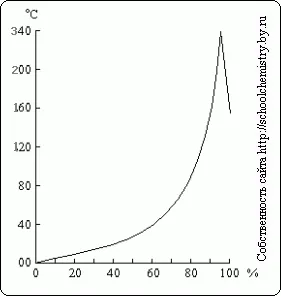
Фиг. 16. точките на кипене на разтвори на H 2SO 4. разтвори на H 2SO 4.
Когато кипене разреден разтвор на сярна киселина от тях, дестилирана вода, с температура на кипене се повишава до 337 ° С, когато тя започва да дестилира 98,3% H 2SO 4 (фиг. 16). Напротив, от по-концентрирани разтвори се изпарява излишък серен триоксид. Парата, кипяща при 337 ° С сярна киселина е частично дисоциирана в Н 2О и SO3. който отново са свързани с охлаждане. Висока точка на кипене на сярна киселина позволява да се използва за разделяне чрез нагряване на летливи киселини от техните соли (например, HCl от NaCl).
Монохидратът могат да бъдат получени чрез кристализация на концентрирана сярна киселина при -10 ° С
Сярна киселина.
1-ви етап. Пещ пирит.
1) смилане на железни пирити (пирит)
2) метод "кипящ слой"
3) 800 ° С; отстраняване на излишната топлина
4) увеличаване на концентрацията на кислород във въздуха
Етап 2. След пречистване, сушене и топлинна серниста газ влиза устройството за контакт, където окислява до серен триоксид (450 ° С - 500 ° С; V2 О5 катализатор):
Трети етап. Абсорбцията кула:
Водата не може да се използва, поради образуването на мъгла. Нанесете керамичен дюза и принцип противоток.
Не забравяйте! Сярна киселина е необходимо да се излива вода на малки порции, а не обратното. В противен случай, насилие химическа реакция може да се появи в резултат на което един човек може да получи тежки изгаряния.
Сярна киселина - един от основните продукти на химическата промишленост. Той се използва за производство на торове (суперфосфат, амониев сулфат), различни киселини и соли, медикаменти и детергенти, оцветители, синтетични влакна и експлозиви. Използва се в металургията (разпадане руди, напр. Уран) за почистване на масло и т.н., като изсушител.
Практически важен е фактът, че много силно (над 75%) сярна киселина не влияе на желязо. Това дава възможност да се съхранява и транспортира в него стоманени резервоари. В контраст, разрежда H 2SO 4 лесно се разтваря желязо с водород. Окислителни свойства за не е характеристика.
Силна сярна киселина енергично абсорбира влагата и следователно често се използват за сушене на газове. От много органични вещества, съдържащи в състава си, водород и кислород, е необходимо водата, която често се използва в областта. С с еднакви (както и силни окислителни свойства H 2SO 4) е свързан му разрушителен ефект върху растителни и животински тъкани. Случайно удари по време на работа на кожата или дрехи сярна киселина трябва да се обилно с вода, след това се овлажнява засегнатата област с разреден разтвор на амоняк и отново с вода.
Молекули чиста сярна киселина.
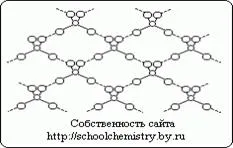
Фиг.1. Схемата на водородни връзки в H 2SO 4 кристал.
Молекулите кристалната форма монохидрат, (НО) 2 SO2 свързани един с друг, а силно (25 кДж / мол) водородни връзки, както е показано схематично на фиг. 1. молекула се (НО) 2 SO2 има изкривена четиристенен структура със серен атом в близост до центъра и се характеризира със следните параметри: (г (S-OH) = 154 ч, RNO-S-OH = 104 °, г (S = О) = 143 пМ, РОСО = 119 ° с йон HOSO3 - .. г (S-OH) = 161, и г (SO) = 145 часа, и при прехода към йон SO4 2- тетраедър придобива правилна форма и параметрите на подравнени [г (SO) = 148 пМ] .Kristallogidraty сярна киселина.
За сярна киселина няколко кристален, съставът на който е показан на фиг. 14. От тях, най-лошо водата представлява оксониева сол: H3 О + HSO4 -. Тъй като въпросната система е много податливи на преохлаждане всъщност наблюдава там минусови температури са много по-ниски температури на топене.
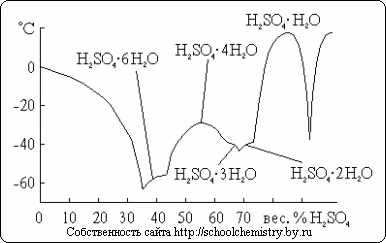
Фиг. 14. температури на топене в О системата Н2 · H 2SO 4.