Моларното проводимост на електролитни разтвори
Моларен разтвор проводимост # 955; е реципрочната стойност на съпротивление на разтвор, съдържащ 1 мол на разтвореното вещество и поставен между електродите, разположени 1 см. От проводимост # 954; и моларната концентрация на разтвор С моларен проводимост е свързано със следното равенство:
, Ом -1 cm 2 мола -1 (3.34)
Моларното проводимост на двете силни и слаби електролити се увеличава с намаляването на концентрацията (ᴛ.ᴇ. увеличаване разреждане на V = 1 / C), достигайки гранична стойност # 955; о. наречен моларен проводимост при безкрайно разреждане (фигура 3.8 -. 3.9).
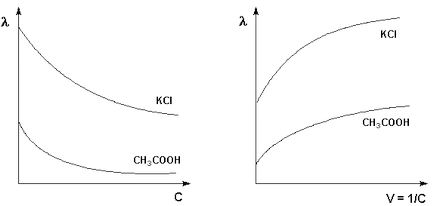
F. Kohlrausch показа, че моларното проводимост на електролитни разтвори безкрайно разрежда всяка от йони прави независима принос, и # 955; о е сумата от моларните проводимостта на катион и анион # 955 + и # 955 - (т.нар йон мобилността) и формулирани закона на движението за независимост на йони:
Моларното проводимост в безкраен разреждане е сумата на мобилност електролитна катион и анион на електролита.
Заместването на този израз в уравнението на Арениус (3.35) и се предполага, че в безкрайно разреждане на степента на дисоциация # 945; равно на единство, ние получаваме:
Електролитно мобилност е съществена характеристика на йон отразява участието си в проводимостта на разтвора.