Глава 2 от уравнението на състояние на материята
2.1. Топлинно-калорични уравнения на държавната
Общият брой на топлинна и термодинамични уравнения състояние на превозното средство се определя от броя на степени на свобода, т.е. включително въздействието върху превозното средство на обобщените сили. Тези уравнения са установени емпирично или е статистически методи за физика.
За прост TC (броят на степените на свобода, N = 2), която има един обобщен сила механични - davlenier. конюгат външен parametruV. взаимодействие с околната среда се характеризира само с едно външно параметър промяна в реакцията, (общи координира) - obemomV и temperaturoyT (независим параметър). След това състояние на равновесие на вътрешни параметри: налягане и вътрешни energiyuU може да се изрази като функционални зависимости: р = р (V, Т) - термичен уравнение на състоянието и U = U (V, Т) - калории уравнение на състоянието.
Термично състояние уравнение за прости TS могат да бъдат представени под формата на връзка: F (р, V, Т) = 0. Това уравнение е термодинамичните състояния на повърхността или повърхностите. За идеален газ уравнение на състоянието е термично Клапейрон уравнение: PV = МРТ. където R - специфичен постоянен газ.
Sostoyaniyaidealnogo уравнение калоричност газ може да се получи от Джаул закона: "Вътрешен sistemyU термодинамична енергия при Т = конст е независима от obemaV:
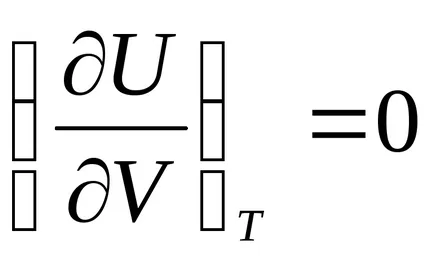
Разнообразяване на уравнение U = U (V, Т), ние получаваме:
,
където
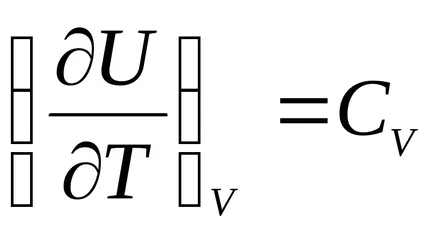
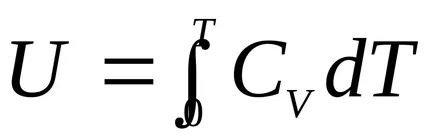
т.е. на вътрешната енергия на идеален газ е функция на температурата:
.
Калорична и топлинна уравнение на състоянието на идеален газ може да се получи от молекулно Kinetic Concepts.
2.2. Thermal уравнение на състоянието на идеален газ
Формално определя като слушането Клапейрон уравнение gazmozhno идеален газ:
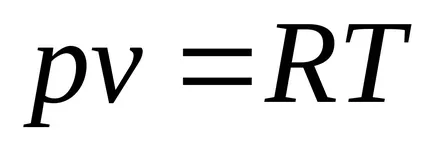
От физическа гледна точка на идеален газ - газ, чийто молекули лишен площта (обем на молекулите на газа в съда - Vmol< , където к = 1.380658 (12) 10 -23 [J / K] - Болцман константа;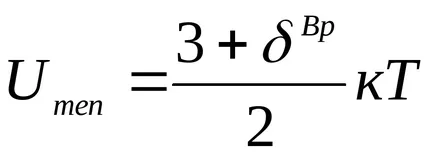
Към 1 кг: PV = RT. където R, J / КГК - специфичен постоянен газ в зависимост от вида на газ, стр. Pa об. m 3 / кг; Т К.
За един мол от:
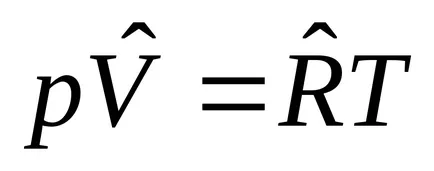

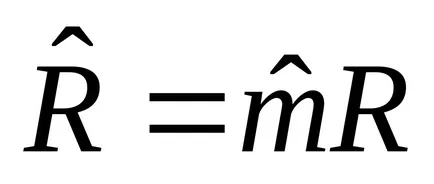


5. 1метър 3:
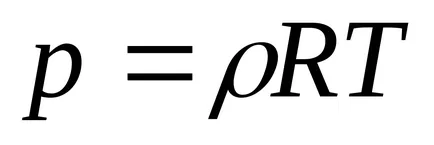
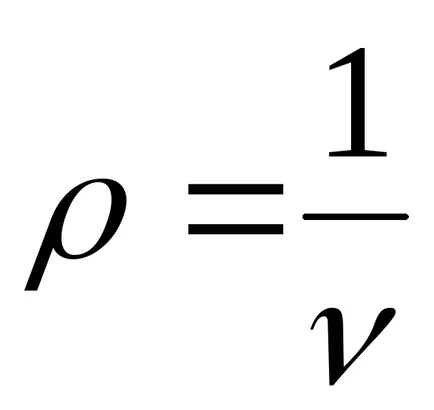
6. едно m 3:
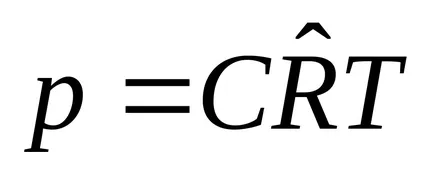
2.3. Термично състояние уравнение за реални газове
Специфичната форма на топлинна уравнение зависи от състоянието на агрегиране и вида на материала. Сега е добре развита уравнение на състоянието само реални газове. За уравнение на състоянието на кондензираната материя са изключително редки, тъй като те не са необходими за практически изчисления.
Форма на уравнението на състоянието на реални газове е силно зависи от размера на частиците и тяхната структура и естеството на взаимодействието между тях. Потенциалната енергия на взаимодействие Udvuh молекули зависи от разстоянието между центровете им -r. t.e.U = е (R). реални газове молекули имат краен размер и са привлечени един към друг със сила, която се увеличава с намаляване на средното разстояние между молекули, за разлика от идеален газ kotorogoU ш (R) = 0.
За изчисляване на потенциалната енергия U се използва предимно от Ленард-Jones:
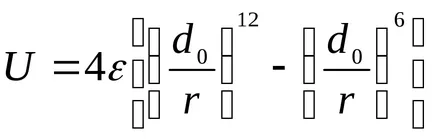
наименованията ценности

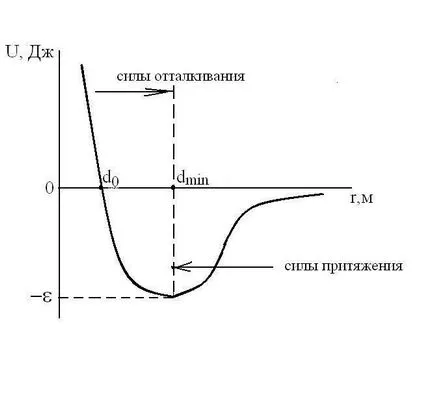
Взаимодействие между молекули сили
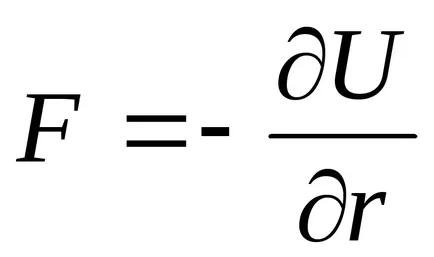
1 / R 6. сила и vzaimodeystviyaF
1 / R 7. За малки rasstoyaniyr (с енергични молекули подход) U
За сравнение, ние се отбележи, че за Кулон взаимодействието потенциал U
1 / R 2. Така, ван дер Ваалс сили намаляват с увеличаване rasstoyaniyar между частиците е много по-бързо от силата на Кулон. Затова държавната уравнение за реални газове обикновено не са подходящи за плазма. За плазмено състояние уравнение е получен отделно (Debye).
Взаимодействие сили в зависимост от разстоянието между частиците (F = F (R)) се използват за изчисляване на коефициентите в различни уравненията на състояние и действителната плазмен газ.
Най-простият състояние уравнението за реални газове е уравнението на ван дер Ваалс (1873) (В момента има повече от 150 емпирични уравнения). Това уравнение е от вида:
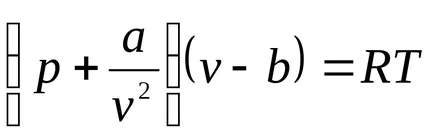
където б - корекция за молекулно обем, A / V 2 - коригиран за молекулно или вътрешно налягане определя чрез взаимното привличане на молекулите на газа. Konstantya и б зависят от вида на газ (от естеството на веществото).
За течности, това уравнение е силно в противоречие с експерименталните данни. Това уравнение показва възможното съществуване на два етапа и води до извода, че е налице критична точка. Ако атрибут параметри р, Т, V до критичната parametrampk, Тс, VK на критичната точка на фазовата диаграма и идентифициране
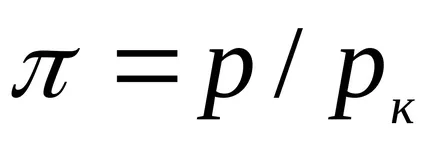
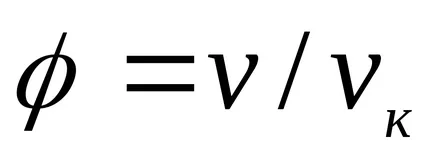
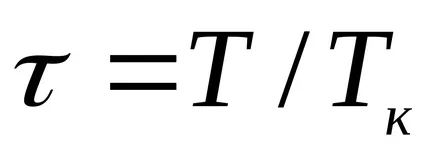
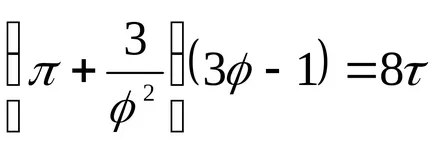
който изразява правото на съответните държави.
Съответните държави-членки, се наричат с различни вещества, които имат едни и същи параметри, посочени




За vadervaalsovskogo газ Rk = 2.67.
Отклонение недвижими газ да свойства на идеален газ способността за пресоване може да се характеризира с величината на коефициента на свиваемост или
За идеален газ Z = 1. За недвижими gazaZ ≠ 1. Големината на коефициента на свиваемост зависи от налягането, температурата и вида на газ и може да бъде по-голяма или по-малка от единица, в зависимост от тези фактори.
Формулите на състояние могат да бъдат получени за реален газ, това взаимодействието на частиците. Тези уравнения се наричат virial уравнението на състоянието, което от V - форма са както следва:
,
където А (Т) В (Т) C (T) - първи, втори и трети virial коефициенти, които зависят от температурата. virial уравнение на р-форма има формата:
Коефициентите А (Т) В (Т) C (Т), свързани с коефициенти А '(T), В' (T) C * (Т).
Първият коефициент (Т) се определя от двоични сблъсъци на частиците, вторият коефициент В (Т) - тройни сблъскване на частици и т.н. Едновременно сблъсък на голям брой частици - е малко вероятно. Най-важната роля, която играе двоични сблъсъци на частици. Ако сметката си от дясната страна на virial уравнения са запазени само две условия. Един пример за това уравнение е уравнението на ван дер Ваалс сили. коефициент на The (Т) се определя чрез интегриране на двоичен потенциал сблъсък. Колкото по-високо налягане, трябва да се разглежда на броя думи в дясната страна на уравнението virial толкова по-голям.
Термичното състояние уравнения за различните вещества също се определят от експерименталните данни за свиваемост Z = р
