Фактори, влияещи на хидролиза сол
По-слабата киселина (и / или основа), по-хидролизата се подлага на негова сол. сол хидролиза постоянно се увеличава с намаляване киселина дисоциационна константа (и / или база):
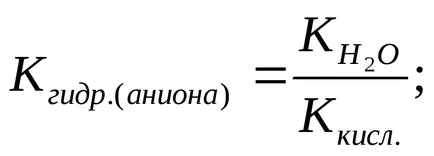
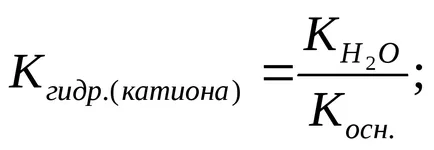
Степента на хидролиза (з) може да бъде изчислена по формулата
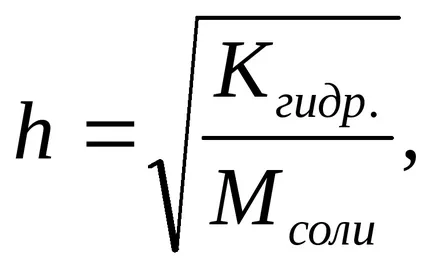
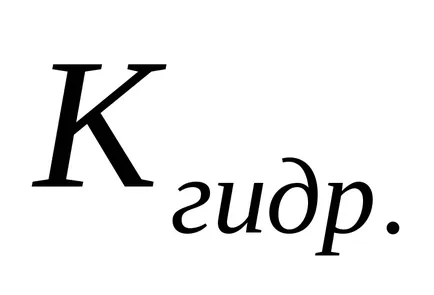
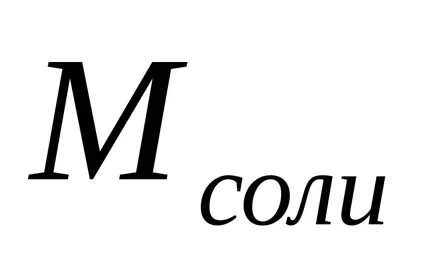
С намаляване на концентрацията на сол в разтвор се увеличава степента на хидролиза, т.е. "Хидролиза се засилва."
Хидролиза - обратими ендотермичен процес протича с абсорбцията на топлина (ΔNgidr> 0.). В съответствие с принципа на Le Шателие чрез загряване на хидролиза равновесни смени към ендотермична реакция, т.е. образуване на продукт и, следователно, "хидролизата амплифицира." При охлаждане - хидролиза равновесие се измества към изходните реагенти, т.е. "Хидролиза е отслабена."
Наличието на чужди вещества, съдържащи "същото име" йони.
Присъединителните соли на продуктите на хидролизата в разтвора в съответствие с принципа на Le Шателие води до изместване на равновесието към хидролиза на изходните реагенти, т.е. "Хидролизата се потиска."
а) NH4 + + Н 2О
Хидролиза на катиона се потиска в присъствието на силни киселини, повишаване на концентрацията на Н + йони.
б) F - + Н 2О
Хидролиза на аниона се потиска в присъствието на силни основи, които увеличават концентрацията на ОН - йони.
6.Osnovnye методи за получаване на оксиди и хидроксиди
6.1. Методи за получаване на оксиди
Обикновено вещества реагират с кислород (реакция горене).
2Ca + o2 → 2CaO
Термичното разлагане на комплексни вещества.
- метални хидроксиди губят вода при нагряване:
2AL (ОН) 3 → Al2O3 + 3H2O;
с изключение на хидроксиди на алкални метали, които се топят без разлагане;
- слабо разтворима форма киселина оксиди при нагряване са подходящи за тях,
киселина, силициев (IV)
- лесно се разгражда сол, киселина образуване летливи оксиди:
карбонати и бикарбонати, сулфити:
оксид, карбонат оксид
Въглероден Калций (IV)
- соли, съдържащи аниони - оксидиращи при нагряване се подлагат на вътрешномолекулна редокси:
амониев хром (III)