Електролиза на воден разтвор на натриев хлорид
Химични процеси по постоянен ток и изолационен електрон наречената електрохимична. Според първия закон на Фарадей, масата на вещества утаява върху електродите пряко пропорционална-ционални на количеството електричество преминава през електролита.
Според втория закон на Фарадей, същият брой elektrichest-случи по преминава през електролита, електродът ще застане еквивалентни тегла на различни вещества, т.е. за изолиране на електрода на един еквивалент поток всички вещества, необходими за да се изразходва същото количество електрон-trichestva (96,500 кулони), нарича номер Фарадей (F).
Cl F = 96 500 = 26.8 (ампер часа).
Теоретичната масата на веществото може да бъде изчислена по формулата, съюзът извайвам закон две Фарадей:
# 964; - продължителността на електролиза, един час;
А - йонна маса, г / мол;
F - Фарадей номер, CI;
Е - електрохимична еквивалент, г / Cl.
Цел: да се получи хлор и водород чрез електролиза на воден зол-ра натриев хлорид и натриев хлорид се използва за получаване на белина. За да се изследва решение след електролиза.
Реагенти: наситен разтвор на NaCl, изсушава се Са (ОН) 2. KI, разтвор на нишесте, лакмус, фенолфталеин, магента.
Оборудване: U-образна клетка с пореста азбест повторно Hyvinkää, въглероден анод, катод желязо, изправяне-Tel, амперметър, волтметър, набор от проводници, гумена тръба, калциев хлорид тръба, епруветки, преса, LU-ранг.
Текущата работа: събиране на инсталацията в съответствие със схемата, показана на фигура 1.
Електролитната клетка се излива в разтвор на натриев хлорид. Тръбата на калциев хлорид излива 2 грама на гасена вар и е прикрепена към клетката. Хлорът преминава през тръба калциев хлорид, реагира с гасена вар съгласно уравнението:
Първоначално изчислена маса необходимо хлор за реакцията с 2 г на гасена вар. Според изчисленото тегло на хлор-ност определя продължително електролиза на ток от 1 ампер или 2 съгласно уравнение (1). След това включва устройството в мрежата и електролиза се извършва за изчисленото време, едновременно събиране на водорода в епруветката и тестване. След над-съвършен деактивиране на работа на устройството, калциев хлорид тръба е изключен и получената белина се проверява за наличието на активен хлор. За тази част на прах вар с разтвор на калиев йодид и разтвор потока vayut нишесте.
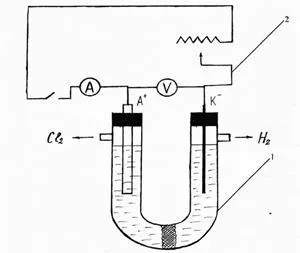
Фиг. 1. Устройство за електролиза на натриев хлорид
1 - електролизна клетка с порьозна преграда азбест; 2 - В-токоизправител 24М.
Допълнително проучване анодното отделение и катода на рН. Разумно по изсипва тръби 2-3 мл на катод и анод пространство и прибавяне към тях на съответния индикатор.
Осъществяване на резултатите.
1. Напишете уравнението на електролиза реакции и доказателства, получени-ционни продукти.
2. Осигуряване на необходимите изчисления.
3. Моля, опишете наблюдаваните явления.
Lab № 5