Valence на хлор FeCl2, felc3, колко е забавно!
Valence е способността на клетките да се прикрепят към другите елементи.
Това означава, че валентността на -. Броят показва редица елементи, които могат да се закрепват към конкретен атом. Определя от броя на несдвоени електрони възбужда и спокоен глас атома.
Хлорът е елемент от седма основна група podrugppy, третия период на периодичната система на химичните елементи. Атомния номер на хлор - 17. го пише както Cl Chlorum. Хлорът е активната част на неметални и халоген група.
валентност и окисление състоянието на хлорните атоми в молекулата

Окислението числено определен в състояние на атом в съединението. тя се нарича номер окисление. Определяне които обикновено смята, че проста ковалентни съединения положителна стойност на мощността е равен на броя на елементите окисляване съставен от свързващия атом електронна двойка, и отрицателна стойност на степента на окисление - броя на изтегляне на електрони двойки. Следователно, определянето на степента на окисляване се счита, че съединенията се състоят само от положително и отрицателно заредени йони.
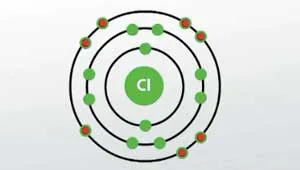
Говорейки на хлор, неговата валентност и окисление в молекулата, следните стойности:
- Valence на - 1.
- Степента на окисление - 0
Дали валентност фосфор силиций азот
Каква е валентността на други вещества, често взаимодействие с хлор?
- Валентността на азот. Азот в периодичната таблица, представено с буквата N. Може еле същества под формата на различна валентност в зависимост от съединението. Тя отговаря дори дробна валентност. Това е напълно възможно да разгледаме пример азотния окисляване: N2O - моновалентен азот (райски газ) NO - двувалентна. NO2 (азотен диоксид, кафяв газ). Азотни съединения, в окисление 5 - азотен оксид (V) N2O5, азотна киселина и нейните соли - нитрати и др.
Въпреки това, валентността на азот = 3.
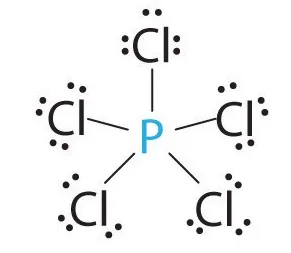
- Фосфор (Р) е в третата период, V група, основните подгрупа на периодичната система на Менделеев. валентност на фосфор може да бъде различен, всичко, както при всяко друго вещество, се основава всъщност с всяко химично вещество, се случи фосфор връзка. Независимо от това, валентност на фосфор е samog III, В.
- Силиконовата (Si) - е 3-период, IV група на основната подгрупа на периодичната система. Валентността - 2, 4.
Валентността на хлор в органични съединения, във възбудено състояние на хлороводород, в горния оксид
Валентността на хлор в органични съединения могат да бъдат различни в зависимост всъщност на съединението.
Основната реакция на хлор с органични вещества:
- С наситени съединения:
СН3-СН3 + Cl2 → C2H5Cl + HCl
- Присъединява ненаситените съединения на множествени връзки:
СН2 = СН2 + Cl2 → Ci-СН2-СН2-CI
- Ароматни съединения, заместени с водороден атом с хлор в присъствието на катализатор (например, AlCl3 или FeCl3):
C6H6 + Cl2 → C6H5Cl + HCl
В undriven състояние в хлор ниво атом енергия от 3 е 1 несдвоен електрон е така спокоен глас хлорен атом може да покаже валентност 1.
Във възбудено състояние - валентност 3.
Висш оксид е оксид, където елемент притежава висока степен на окисление.
Cl2O7 - хлор оксид (VII) - чл. окислява. Cl (7) - главен оксид.
Валенцията хлор с метали, фосфор, сребро, натрий, водород, кислород, калций, алуминий, с неметали, с желязо
Като цяло, валентност - един от най-сложните теми в областта на химията, за да го разбера, има много материал, за да чета. Без да знае основните закони и правилата на химия, никой не може да разбере какво е валентност, много по-малко се научите как да го идентифицират.
Взаимодействие с метали:
Хлорът реагира директно с почти всички метали, обаче, някои реакции изискват влага или топлина.
Взаимодействие с неметали:
С неметали (с изключение на въглерод, азот, флуор, кислород и инертни газове) образуват съответните хлориди.
В различните съединения с различна валентност като хлор, с метали (сребро, натрий, желязо, алуминий) валентност хлор = 1, с неметали, имащи различна валентност, но най-често, също 1. В съединенията с хлороводород валентността = 1.
Обикновено CL винаги има валентност от 1, комбиниране с вещества изключения са вещества с валентност VII.