свойства на разтвори
Решения заемат междинно положение между механични и химически смеси от съединения. Еднородност разтвори и топлина поколение при разтваряне на някои вещества ги прави подобни химични съединения. За разлика от разтвори на химични съединения е, че съставът на разтвора може да варира в широки коридори.
Освен това, свойствата на разтвора може да се определят свойствата на отделните компоненти, които не се наблюдава в случай на химическо съединение.
Парно налягане над разтвор
Дневна светлина молекулни вещества от течност до пара се нарича изпаряване. Дневна светлина молекули на веществото от състоянието на пара към течния nazyvaetsyakondensatsiey.
Ако течността се съхранява в затворен съд, равновесието се достига, когато скоростта на изпаряване на течността, равна на скоростта на пара кондензация.
Натиск пара в равновесие с течността, се нарича наситен парното налягане на течността. Това максимално налягане на парата, която се развива течност. наситен Налягането на парите зависи от естеството на течността и температурата и не зависи от размера на течност.
Повърхността на разтвора, за разлика от повърхността на чист разтворителя, частично заета от разтворените молекули. Следователно, броят на молекули на разтворителя се изпарява във единица време с повърхността на разтвор Една единица е по-малка от една единица на повърхността на разтворител. Следователно, при същата температура, парното налягане над разтвор винаги ще бъде под налягането на парите на разтворителя.
Количествено, тази връзка се изразява чрез закон на раул F. "Идеалните разтвори при постоянна температура стойност на относителното налягане намаляване на парите на разтворителя над разтвора се равнява на молната фракция на разтвореното вещество."
P0 - парното налягане на чистия разтворител,
P - парното налягане над разтвора.
Идеалното решение - решение, при което междумолекулни сили са равни. Когато веществата А и В представляват идеално решение, силите между молекулите А ... А ... А и Б ... B са равни.
От право Раулт, че парата над смес от течности А и Б съдържа и двете от тези вещества, и налягането на наситената пара на всяко вещество в сместа е равна на произведението на молната фракция на веществото в наситен парно налягане над чисто вещество, т. Е:
RA - парно налягане по-горе разтвор на вещество А,
NA - мол от съединение А rasvore,
P 0 A - парното налягане над веществото А чисто вещество.
Точката на кипене и (кристализация) разтвор Точка на замръзване
Точката на замръзване (кристализация) на течността - е температурата, при която налягането на наситената пара течност е налягането на наситените пари на кристали.
Тъй като съгласно закон на раул, F., парното налягане над разтвор нелетливи вещества под парното налягане на чистия разтворител, по този начин, като в същото външното налягане на разтвора над точката на кипене на чистия точката на кипене на разтворителя, и замразяване температурата на разтвора под точката на замръзване на чист разтворител.
Количествено, тази зависимост е разположен Е. Раулт закон "повишаване или понижаване на температурата на кипене на точката на замръзване на идеалното решение е директно пропорционална на концентрацията на разтвореното вещество molal".
Виж - molal концентриране на разтвора, мол / кг
Е - ebuleoskopicheskaya постоянна ° С / мол,
По - cryoscopic константа, K / мол.
Е и К показва точка на кипене височина и замразяване понижаваща точката на разтвор, в който 1 кг разтворителят разтварят 1 мол вещество.
ПРИМЕР 1 вода E = 0.52 ° С / мол, К = 1.86 ° С / мол.
Така че, когато се разтваря в 1000грам вода 342 грама захар (С12 Н22 O11) и 46 г етанол (С2 Н5 OH), температурата на всеки разтвор е замразяване 0 намалява до 1.86.
Например: да се определи точката на замръзване на 40 тегловни%. воден разтворител, глицерол (С3 H8 О3). 100 г разтвор, съставен от 40 г глицерин и 60 г вода. Така 1000 г вода (разтворител), съдържаща 666 г глицерин. Молекулното тегло на С3 H8 О3 равна на 92 molal концентриране на разтвора 666/92 = 7.24 мола / кг
A: точката на замръзване на воден 40% разтвор на глицерин - 13,5 0 ° С
ПРИМЕР 2 разтвор, съдържащ 11,04 грама на глицерин в 800 г вода, кристализира при - 0.279 0 ° Изчислете мол тегло глицерол.
Решение: чиста вода от кристализация температура 0 0 ° С, като по този начин понижаване на температурата на кристализация АТ = 0- (-0.279 0) 0,279 = 0. glitserinam Тегло (г) на 1000 г вода,
m = 11,04 * 1000/800 = 13,8
заместител стойност мин уравнение
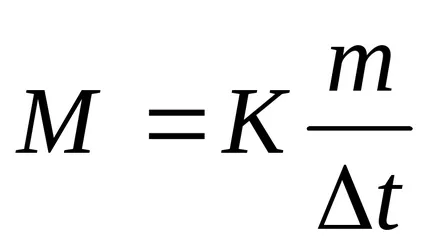
след моларната маса на глицерин
М = 1,86 * 13,8 / 0,279 = 92 г / мол.
Измерването на температурата на кипене и замразяване решения, базирани ebullioskopicheskie и cryoscopic методи за определяне вещества молекулно тегло. Когато се използва следната формула:
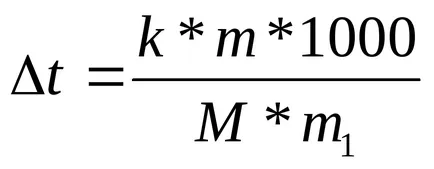
K - или ebuleoskopicheskaya cryoscopic постоянен;
MI съответно маса М на разтвореното вещество и молната маса;
m1 - масата на разтворителя.