свойства на аминокиселини
Аминокиселини (АА) - органични молекули, които се състоят от първични амино групи (-NH2), карбоксилна киселина група (-СООН) и органичен радикал R (или странични вериги), която е уникална за всеки AK
амино киселини функция в тялото
Примери за биологични свойства на АК. Въпреки, че се срещат в природата повече от 200 различни AC само около една десета от тях са включени в протеините, а други да изпълняват други биологични функции:
- Те са градивните елементи на протеини и пептиди
- Прекурсорите на много биологично важни молекули получени AK. Например, тирозин е предшественик на съединение хормон тироксин и кожата пигмент меланин, тирозин и DOPA прекурсор (дихидрокси-фенилаланин). Това предаване невротрансмитер импулс в нервната система. Триптофанът е прекурсор на витамин В3 - никотинова киселина
- Източници на сяра - сяра AK.
- AK участват в много метаболитни пътища, като глюконеогенезата - синтеза на глюкоза в организма, синтезата на мастни киселини и други.
В зависимост от позицията на амино групата на карбоксилната група на АК може да бъде алфа, α-, бета и гама β-, γ.
Алфа - амино група, прикрепена към въглеродния атом, съседен на карбоксилната група:
Бета - амино група, разположена в втория въглероден атом от карбоксилната група
Гама - амино група на трето ugleroe от карбоксилната група
Структурата на протеини се само алфа-AK
Обща характеристика на алфа-AK протеин
1 - Оптична активност - аминокиселини имот
Всички AK за isklyuchekniem глицин, проявяват оптична активност, тъй като съдържа най-малко един асиметричен въглероден атом (хирален атом).
Какво е асиметричен въглероден атом? Този въглероден атом, към който са прикрепени четири различни химически заместител. Защо глицин не показва оптична дейност? Неговите радикални само три различни заместители, т.е. алфа-въглерод не е асиметрична.
Което означава, оптично активна? Това означава, че АК в разтвора може да присъства в двата изомера. Дясновъртящ изомер (+), който има способността да въртят равнината на светлина полето polyarizatsovannogo. Лявовъртящия изомер (-), който има способността да въртят равнината на поляризирана светлина в ляво. Двата изомера могат да се въртят равнината на поляризация на светлината за една и съща стойност, но в обратна посока.
2 - киселинно-основни свойства
Всички AK съдържа най-малко две йонизирани групи - алфа-амино и а-карбоксилна група. Някои съдържа в своята странична верига повече киселинни или основни групи, които са отговорни за киселина-база поведение AK
В резултат на тяхната способност да йонизация може да напише равновесието на реакцията:
R-COOH<-------> R-C00 - + Н +
Тъй като тези реакции са обратими, това означава, че те могат да действат като киселини (пряка реакция) или бази (обратна реакция), което обяснява амфотерни свойства на аминокиселините.
Амфотерен йон - AK имот

Полярността на общо аминокиселини имота
При физиологично рН AK присъства като цвитерйони iony.Polozhitelny заряд носи алфа-амино и карбоксилна отрицателен. По този начин, той създава две protivovolozhnyh такса върху двата края на молекулата AK молекула има полярни свойства.
Наличието на изоелектричната точка (ИЕП) - amingokislot имота
РН, при която нето електрически заряд е нула аминокиселини, и следователно не може да се движи в електрическо поле се нарича PI.
Способността да абсорбира ултравиолетова - ароматни аминокиселини имота
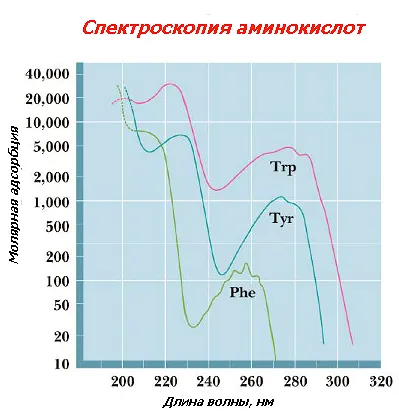
Фенилаланин, хистидин, триптофан и тирозин абсорбира при 280 nm. Фиг. otorazheny на моларен екстинкционен коефициент (ε) на АА. Видимата част на спектъра на аминокиселини не абсорбират, следователно, те са безцветни.
AK може да присъства в два варианта изомери: L-изомер и D-
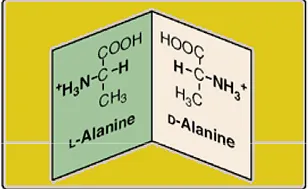
Всички аминокиселини в протеини в L-конфигурация, L-aminokicloty.
Физичните свойства на аминокиселините
Аминокиселините са основно водоразтворими, поради тяхната полярност и присъствието на заредени групи. Те са разтворими в полярни и не се разтваря в неполярни разтворители.
AK имат висока температура на топене, което отразява наличието на силни връзки, които поддържат кристалната им решетка.
Обща характеристика на АК е обща за всички АА и в много случаи, определени от алфа-амино и а-карбоксилна група. AK притежават специфични свойства, които са продиктувани от уникален страничната верига.