Регламент на ензимната активност
Алостерична регулиране придружава от промените в афинитета на ензима към субстрата без промяна на максималната скорост на реакцията. Това е много често срещана и разумно регулиране.
Широко представени коензими като AMP, ADP, ATP, NAD, NADH, NADP, NADPH, лимонена киселина, ацетил-КОА и няколко други, които са едновременно субстрати, и регулатори на ензимни реакции.
Регулирането на ензимната активност се проявява като модификация ковалентна. Откриването на този маршрут - най-важното постижение по биохимия. Активиране и инхибиране на ензимната активност чрез фосфорилиране на кинази, участващи в АТР циклични процеси хормон действие, наличието на хормони в клетъчните мембрани на специфични рецептори - всичко това е нов етап в изследването на регулирането на метаболизма.
Общата схема на регулирането в този случай, са както следва: цикличен AMP (сАМР) е свързана към регулаторна субединица, което води до освобождаването на активните каталитични субединици, т.е., концентрацията на сАМР, образуването му се влияе циклаза и разделяне под влиянието на фосфодиестераза основата регулиране на множество метаболитни пътища. Фосфорилирането е общ регулаторен механизъм метаболитна ензимна активност.
Хормонални регулиране на ензимната активност се крие във факта, че има връзка между действието на хормоните на процесите на транскрипция и модификация на не-хистонови основните протеини. Хормоните могат да действат като ефектори (сензорни сайтове) ДНК и т.н.
Нервната регулация на активността на ензимите изследвани за дълго време (метаболизъм). Животните с нерв напречен разрез доказали, че докато редица ензими в мускулната тъкан променя своите свойства.
Механизмът на действие на ензимите
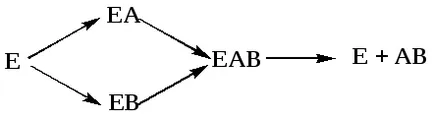
Проблеми на структурата и функцията на ензими, проблемите на техния механизъм на действие са предмет на водещите лаборатории в света. Увеличаването ензимно скорост на реакцията се дължи на факта, че ензимната катализа на ензим е свързан (по принцип обратима) с неговия субстрат за образуване на нестабилен междинно fermentsubstratny комплекс, който се разлага в края на реакцията на освобождаване на ензими и реакционни продукти (Арни Michaelis Menten, 1910 1915). Michaelis не само постулира образуване на междинен ензим-субстрат сложни ES-но изчислява влиянието на концентрацията на субстрат на скоростта на реакцията.
По време на реакцията, има следните етапи:
1. Присъединяване на субстрата молекулата на ензима.
2. Превръщане на първични междинни съединения в един или повече последователни (преходни) комплекси.
3. Клон на крайните реакционни продукти от ензима.
Vreaktsiyah анаболизъм допустим + B AB, ензимът може да се свърже едновременно един с друг и с подложката или двете основи:
Vreaktsiyah катаболизъм, например: ABA + B
б) АБЕА BE + (А + В + С) ЕА + AB + VE
Схема образува междинен ензим-субстрат комплекс е представена на Фигура 4.2. Ако активния център на ензима съдържа коензим, трикомпонентен комплекс се образува (фигура 4.2.).
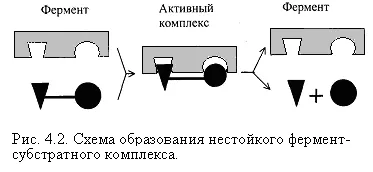
Ензимът реагира със субстрата за много кратък период от време. Съществуването на такъв комплекс за получаване на доказателства само през последните години. При образуването на ензим-субстрат комплекс, включващ водородно свързване, електростатични и хидрофобни взаимодействия, както и в някои случаи, координационни ковалентна връзки. Информация за естеството на връзки могат да бъдат получени чрез електронен спин резонанс (ESR), ядрено-магнитен резонанс (NMR), инфрачервена и ултравиолетова спектроскопия. За каталитична активност е важно пространствена структура на ензима протеин, където части от а-спирали твърда примесени с гъвкави, еластични линейни сегменти, които осигуряват динамични промени на молекулата на ензимен протеин. В каталитичен процес са от съществено значение кореспонденция между ензима и субстрата, както и термодинамични и каталитични предимствата на такова съответствие. Това означава, че между ензима и субстрата трябва да бъде не само пространствен или геометрична допълване, но също електростатични - сдвояването на противоположни заряди (ите) на субстрат и ензим активен център.
По този начин, в механизма на ензимната катализа водеща роля играе междинните ензим-субстрат комплекси, образуване на които се определя от фината структура на активните центрове и изпълнително и уникалната структура на целия ензимни молекули, които осигуряват висока каталитична активност и специфичност на действие на биокатализатори.
Кинетиката на ензимни реакции в зависимост от естеството на реагентите - ензим, субстрат и техните условия взаимодействие - концентрация, рН, температура, присъствието на активатори или инхибитори.