Първият закон на термодинамиката и приложението му в различни процеси
Количеството топлина предава термодинамична система, се изразходва за промяната в своята вътрешна енергия и да направи работата на системата срещу външни сили.
Ако вместо операционна система A на външни органи въведете работа на външни сили A '(A = -А "), на първия закон на термодинамиката може да бъде пренаписана, като:
Промяната във вътрешната енергия на термодинамична система е равно на обема на работата, извършена върху системата от външни сили, както и количеството топлина, прехвърлени на системата в процеса на топлообмен.
Първият закон на термодинамиката е обобщение на закона за запазване на енергията за механични и термични процеси. Например да разгледаме процеса на инхибиране на лентата на хоризонталната повърхност чрез сила на триене. скорост бар намалява, механичната енергия на "изчезнали". Но докато повърхността на триене (железопътен повърхност и хоризонталата) се нагряват, т.е. Механична енергия се превръща във вътрешния.
Прилагане на първия закон за различни термични процеси
Обем е непроменена: V = конст. Следователно, ΔV = 0 и А = -А '= 0, т.е. не механична работа не е направено. Първият закон на термодинамиката ще бъде:
Когато изохорен процес цялата енергия, действаща на газ чрез топлообмен, изцяло консумирана да увеличи своя вътрешна енергия.
Температурата на газовата не се променя: Τ = конст. Ето защо, АТ = 0 и ΔU = 0. Първият закон на термодинамиката ще има следния вид:
Когато процес изотермични цялата енергия, действаща на газ чрез топлообмен, то е за извършване на работа на газ.
Налягането не се променя: р = конст. Разширяващият газ не работи Α = p⋅ΔV и се нагрява, т.е. променя вътрешната си енергия.
Първият закон на термодинамиката е в следния формат:
Когато изобарен процес количеството топлина, предава термодинамична система, се изразходва за промяната в своята вътрешна енергия и да направи работата на системата срещу външни сили.
Това е процес, при който не настъпва топлообмен с околната среда, т.е. Q = 0
Количеството топлина при получаването на която температурата на тялото се увеличава от една степен, наречен топлина. Според тази дефиниция
топлинен капацитет се различава в зависимост от условията, при които тялото се извършва загряването - при постоянен обем или постоянно налягане.
Ако тялото нагряване се извършва при постоянен обем, т.е.. Е. DV = 0, работата е нула. В този случай, топлината се предава на тялото е само промяна в своята вътрешна енергия, DQ = DE. и в този случай топлинен капацитет, равен на промяната на вътрешната енергия при промяна на температурата от 1 К, т. е.
Що се отнася до газ, след това.
Тази формула определя мощността на 1 мол на идеален газ, наречен моларен. При нагряване на газ при постоянно налягане варира обема си, съобщава топлината на тялото е не само да се увеличи вътрешната си енергия, но също така и за извършване на работа, т.е. DQ = DE + PDV. Специфичната топлина при постоянно налягане.
Имайки предвид това, ние откриваме
Съотношението е стойност, характерна за всеки газ, и определя броя на степените на свобода на молекулите на газа. Измерване на топлинния капацитет на тялото е така метод за директно измерване на микроскопични характеристики на нейните съставни молекули.
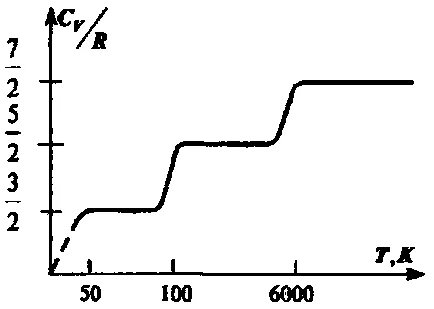
Формулите за идеален капацитет за газ топлина приблизително право описват експеримент, където основно на елементарните газове. В съответствие с формулите, получени по-горе, капацитетът на топлина не зависи от температурата. В действителност, има една снимка е показано на фиг. получени емпирично за двуатомен водород газ. В станция 1 газът се държи като система от частици с транслацията степен на свобода, в зона 2 се задвижва движение, свързани с ротационни степени на свобода и, накрая, в областта 3 има два вибрационни степени на свобода. Стъпките в кривата в добро съгласие с формула (2.35), но между увеличава топлинен капацитет с температура, която съответства на двете nonintegral променлив брой степени на свобода. Това поведение на топлинния капацитет показва провала контакт на най-доброто представяне се използва за описание на недвижимите газ на веществото.
Равновесието и nonequilibrium обработва .Obratimye и необратими процеси.
Нека цилиндъра с буталото е пълна с газ. Ако буталото е фиксиран, и температура на околната среда е непроменен, газът в цилиндъра е в термодинамично равновесие: газово налягане във всички точки в рамките на същия цилиндър, а температурата е температурата на околните структури.
Ако компресирате газа в цилиндъра под буталото, след което състоянието му ще се промени: намалява обема и повишаване на налягането. Виждаме, че термодинамичните параметри се променят с времето, не е, както се казва, термодинамичен процес. Но ако компресията е много бавно, а след това във всеки един момент ще има време да се създаде ново състояние на равновесие с новите стойности на налягане и обем. Такива процеси бавно се наричат равновесие.
Ако след изтичането на бавен процес равновесие на компресия да провежда в обратна посока, т.е.. Е. За да се осигури газ бавно да се разширява, тя ще мине през една и съща последователност от състояния на равновесие, и че при компресия. Поради тази причина, процесите на равновесие се наричат обратими ..
Промяната на процеса състояние, придружено от дисбаланс в системата, се нарича извън равновесие. Нека буталото компресира газа в цилиндъра бързо. След това състояние на равновесие ще бъдат разбити, и едва след известно време (времето за почивка), газът преминава в ново състояние на равновесие. Такъв процес на компресия е необратим: бързото налягане компресия под буталото в първия момент е по-голям, отколкото останалата част на цилиндъра при бързото разрастване - по-малко.
Да приемем, че за простота необратимостта на цикъла се дължи на факта, че обменът на топлина между работния флуид и източник на топлина (помисли хладилник и "източник" само отрицателно температура) се появява при крайни температурни разлики, т.е. нагревател, отказвайки се от топлина, охладена до АТ. хладилник и се загрява до? Т.
Всеки процес, който не отговаря на условието за обратимост, ние nazyvaemneobratimym процес. Един пример за необратим процес е процес на спиране на тялото под действието на силите на триене. При тази скорост на тялото намалява и спира. Енергията на механичното движение на тялото се консумира, за да се увеличи енергията на случаен движение на частиците в организма и околната среда. Енергията се разсейва. За да продължите процеса за компенсиране на движение изисква охлаждане на тялото и околната среда. В този случай, топлинни двигатели, бойлер и хладилник - не са съвършени, те не разполагат с безкраен капацитет топлина, и в процеса на получаване или даване на допълнителна температура T.?
Цикличните процеси. ефективност на цикъла. цикъл на Карно.
Карно Cycle - идеален термодинамичен цикъл. Карно топлинен двигател работи съгласно този цикъл има максимална ефективност на всички машини, при което максималната и минималната температура цикъл извършват съвпадат с максималните и минималните температури на цикъл на Карно. 2 се състои от две адиабатни и изотермични процеси.
Ото и Дизел.
Ото цикъл - термодинамичен цикъл, описваща процеса на работа на двигателя с вътрешно горене с запалването на компресираната смес от външен източник на захранване, цикъл бензинов двигател. Кръстен на немски инженер Николаус Ото.
Идеалният цикъл на Ото се състои от четири процеса:
р-V диаграма цикъл на Ото
1-2 адиабатно сгъстяване на работния флуид;
2-3 изохорен доставка на топлина към работния флуид;
3-4 адиабатно разширяване на работния флуид;
4-1 изохорен охлаждане на работния флуид.
където -N = v2 / v1 компресия,
γ - адиабатно индекс.
Идеалният цикъл само приблизително описва процеси в реална двигател, но за технически изчисления, в повечето случаи, на точността на това приближение е задоволително.
Дизел Cycle - термодинамичен цикъл, описващ процеса на работа на двигателя с вътрешно горене с запалване на впръскване на горивото от нагретия работна течност цикъл дизелов двигател.
идеален Дизел цикъл се състои от четири процеса:
1-2 адиабатно сгъстяване на работния флуид;
2-3 изобарно доставка на топлина към работния флуид;
3-4 адиабатно разширяване на работния флуид;
4-1 изохорен охлаждане на работния флуид.
m = v3 / v2 - предварителен фактор разширяване,
γ - адиабатно индекс.
Идеалният цикъл само приблизително описва процеси в реална двигател, но за технически изчисления, в повечето случаи, на точността на това приближение е задоволително.