Принципи на изграждане на електронни конфигурации на атомите
Уреждане на атомни орбитали с електрони се извършва в съответствие с принципа на изключването Паули, правилото Hund и принципа на минимална енергия.
принцип Паули (1925): В атом не може да бъде два електрона със същите стойности на всички четири квантово число.
Нека обясним това с един пример. Помислете два електрона, които са на същото ниво на енергия, затова те имат една и съща стойност. На следващо място, да приемем, че те са в същите енергийни поднива, т.е. те имат също и същи. И накрая, двата електрона трябва да бъдат поставени на една. т.е. ги ценят и също нещо, и да направят това, те трябва да имат противоположни завъртания.
На принципа на Паули води до важни последици.
Следствие 1. атомна орбитална не може да бъде повече от два електрона в съответствие с двете стойности на броя на спин количество.
Следствие 2. Максималният брой на електроните в тази подниво:
т.е. всеки електронен подслой е броят на електроните, равни на два пъти стойността на магнитното квантово число.
Тъй като всеки подслой съдържа орбитали (маса), които могат да колонизират само електрони, тогава максималният брой на електрони в подниво ще бъде:
подслой има. Поради това, че съдържа [1];
подслой има. следователно, че включва;
подслой има. следователно, че включва;
подслой има. следователно тя съдържа.
Следствие 3. Максималният брой на електроните на ниво, равно на два пъти квадрата на главно квантово число:
Тази формула се получава след сумираме броя на електроните в определен от до (Формула Роден-Bury):
Той не счита, взаимодействието между електроните и е валидна за.
Gunda правило: В този подслой електроните са разположени така, че да се върти на общия брой от тях е увеличен, т.е. Само в този случай, конфигурацията на електрон има най-ниския енергия. В същото време не трябва да забравяме, че общият брой на спин в двойка електрони е нула. Това означава, че ако има подниво. те са разположени, както следва:
В противен случай, общото въртене е по-малко от:
Принципът на най-малко енергия. Електроните в един атом не трябва да заемат по-високи нива на енергия за толкова дълго, тъй като има основна свободно пространство, където са разположени електроните ще имат по-ниска енергия.
Този принцип отразява общ модел - максималната стабилност на системата съответства на минимума от своята енергия.
Въпреки това, в този състав, на принципа на най-ниското потребление на енергия е много трудно. В мулти-електрон атоми, както в водороден атом електрон състояние определя от стойностите на същите четири квантово число, но в този случай, електрона е не само в ядрената област и в областта на други електрони. Ето защо, като се има предвид, че енергията в много електрони атоми се определя не само главницата, но и орбитална квантовата номер, Съветския физик VM Klechkovskaya две правила са разработени в един век, до голяма степен ще улесни задачата на поставяне на електроните в атомите:
1. Електроните първи заемат нивата и поднива, за които сумата от цифрите по-долу.
2. Ако по някаква сума от поднива са равни, то тогава има първо пълнене на поднива, за които броят е по-малко важно.
Енергийните атомна орбитала увеличава в съответствие със следния номер: (Фиг.)
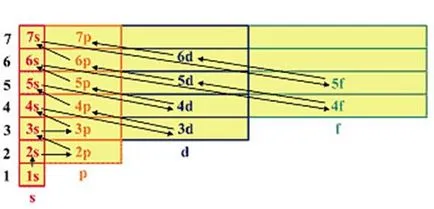
Фигура 2.5 - Последователност на пълнене атомна орбитала на електроните
Да разгледаме последователно пълнене на електронен слой на атомите в съответствие с тези правила. Записаните електронни формули (или конфигурации), които отразяват тази последователност, първата цифра е. писмото, след като отговаря. и горния десен индекс, равен на броя на електроните в това състояние. Например, електронен литиев формула - Въглероден -. хлор - населена електронен слой могат да бъдат представени като квантовата клетки (квадрати или хоризонтални линии) (фигура).
За разлика от електронните формули, използвани тук са не два, а всичките четири квантови числа. Вижда се, че енергията на електроните в мулти-електрон атома се определя като квантовата номер. и; електрони с различни стойности. и при razlichnytolko двойки електрони завъртания. Безплатна клетка в този пример е свободен орбитален което може да отнеме в възбуждане електрона на атома.
Фигура 2.6 - населението на електронен слой, представени под формата на квантовата клетки (квадрати или хоризонтални линии)
[1] - наименование електрон.