Пептидна връзка - studopediya
Аминокиселините в полипептидната верига са свързани чрез се образува амидна връзка между # 945; карбоксилна група на един и # 945 амино група на следващата аминокиселина (Фигура 1.). Образувани между аминокиселини ковалентна връзка се нарича пептидна връзка. Кислород и водород пептид група по този начин заемат транс.
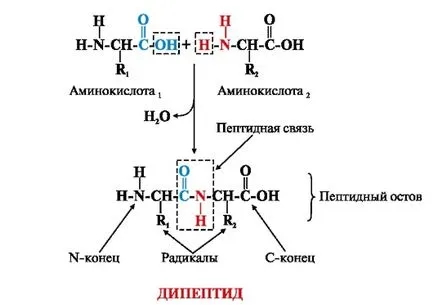
Фиг. 1. Схема на пептид svyazi.V може да се идентифицира всеки протеин или пептид: N-края на протеина или пептида със свободна амино група (-NH2);
С-краят като свободна карбоксилна група (-СООН);
Ostovbelkov пептид, състоящ се от повтарящи се единици: -NH-СН-СО-; Радикалите аминокиселини (странични вериги) (R1 и R2) - група променливи.
И краткото полипептидна верига, както и синтеза на протеин в клетки непременно започва с N-край и С-крайни краища:
Имената на аминокиселини, включени в пептид и образуване на пептидна връзка се -ил затваряне. Например, трипептида горе, наречен треонил-хистидил-пролин.
Единственият променливата част на разграничаване на един протеин от всички други, е комбинацията от радикалите (странични вериги) на аминокиселини, които се съдържат в него. Така индивидуалните свойства и функцията на протеина поради структурата и реда на аминокиселини в разреждането на полипептидна верига.
Полипептидни вериги от различни протеини тяло могат да съдържат повече аминокиселини до стотици и хиляди аминокиселинни остатъци. Тяхната молекулно тегло (мол. Тегло) също варира в широки граници. Така вазопресин хормон, състояща се от 9 аминокиселини, казват те. маса от 1070 Ша; инсулин - от 51 аминокиселини (2 вериги), Mol. маса от 5733 Ша; Лизозим - от 129 амино киселини (една верига), Mol. тегло 13,930 Ш; хемоглобин - от 574 аминокиселини (4 вериги), Mol. тегло 64,500 Ш; колаген (tropocollagen) - от около 1000 аминокиселини (3 вериги), Mol. тегло
Информацията и функция на протеина зависи от структурата и реда на аминокиселини във веригата на променлив, промяна на състава на аминокиселина може да се промени много. По този начин, две задната хипофизен хормон - окситоцин и вазопресин - са nanopeptidami и 2 аминокиселини се различават от 9 (в позиция 3 и 8):
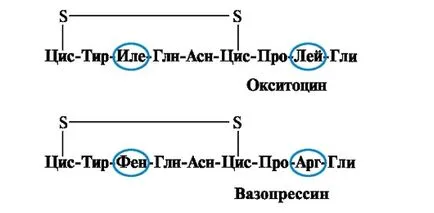
Основната биологичен ефект е да окситоцин стимулиране на матката контракция на гладката мускулатура по време на раждането, и вазопресин вода причинява реабсорбция в бъбречните тубули (антидиуретичен хормон) и притежава съдосвиващи свойства. Така, въпреки големите структурни сходства, физиологичната активност на тези пептиди и целевата тъкан, за които те работят, са различни, т.е. заместване на само 2 от 9 амино киселинен пептид причинява значителна промяна в функция.
Понякога много малко промени в структурата на голям протеин предизвиква потискане на дейността си. По този начин, алкохол дехидрогеназа ензим, който разцепва етанол в човешки черен дроб, се състои от 500 аминокиселини (4) вериги. своята дейност сред жителите на Азия (Япония, Китай и др.) са много по-ниски от тези на европейските граждани. Това се дължи на факта, че полипептидна верига на ензима се заменя глутаминова киселина, лизин в позиция 487.
Взаимодействията между амино радикали играят важна в стабилизирането на пространствената структура на протеините могат да бъдат идентифицирани четири вида химични връзки: хидрофобни, водород, йонни, дисулфид.
Хидрофобни връзки се появяват между хидрофобни неполярни остатъци (фиг. 2). Те играят водеща роля в образуването на третичната структура на молекулата на протеин.
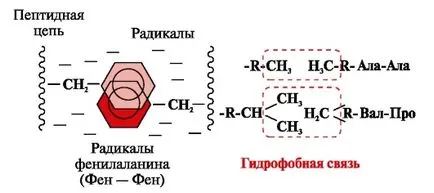
Фиг. 2. хидрофобни взаимодействия между радикали
Водородни връзки - са образувани между полярните (хидрофилни) групи с незаредени радикали с мобилен водороден атом, и групите с електроотрицателна атом (-О- или -N-) (фигура 3.).
Йонни връзки са образувани между полярните (хидрофилни) йонни радикали, притежаващи противоположно заредени групи (Фиг. 4).
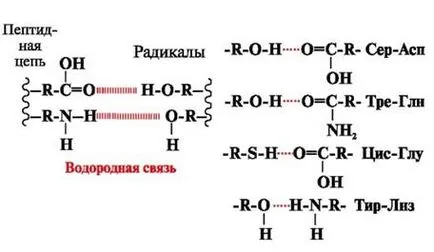
Фиг. 3. водородни връзки между аминокиселинните остатъци
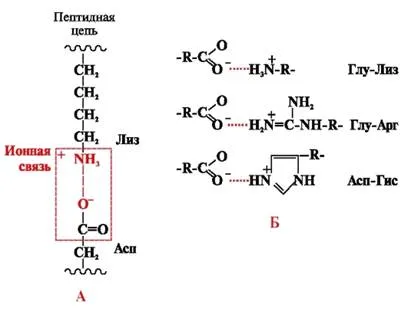
Фиг. 4. йонна връзка между лизин радикали и аспарагинова киселина (А) и примери на йонни взаимодействия (В)
Дисулфидната връзка - ковалентна, образувана от две сулфхидрил (тиол) групи от цистеинови остатъци, на различни места на полипептидната верига (Фигура 5.). Той се среща в протеини, такива като инсулин, инсулинов рецептор, имуноглобулини и други.
Дисулфидните връзки стабилизиране на триизмерната структура или единична полипептидна верига асоциирано с взаимно 2 вериги (например, А и В вериги на инсулин хормон) (фиг. 6).
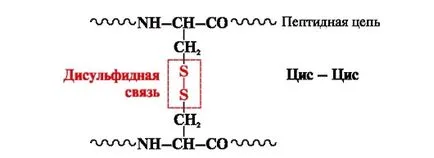
Фиг. 5. образуването на дисулфидна връзка.
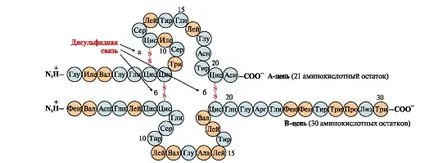
Фиг. 6. Дисулфидната връзка в молекулата на инсулин. Дисулфидните връзки: един между цистеинови остатъци от веригата на А (а) между веригите А и В (Ь). Цифрите - позицията на аминокиселините в полипептидните вериги.