Номенклатура и изомерия Arenes
Най-простият представител на аренът е бензен. Рас гледат повече от неговите свойства.
Бензенът е бистър, безцветен legkole-tuchuyu течност с характерна миризма (това е така, защото на силна миризма ароматни съединения произтичащи им хостинг проект комплект). Точка на топене 5,5 ° С, точка на кипене - 80 ° С Тя се смесва с вода, но се смесва с най-добре радикално орга разтворител. Това е разтворител за неполярни органични вещества. Опушен пламък изгаря (частичен combu дори по-рано) за образуване, освен въглероден диоксид и вода, значителни количества от сажди-ТА. Токсични и като течност и като пара чрез инхалация.
1. В промишлеността бензен получава масло реформинг, кото-Ing същество дехидрираща алкани масло, за да образуват циклична скелет. В "чисти" форма оси novnaya реформиране реакция - е дехидрогенирането на хексан:
Освен това, бензен е летливи продукти Кок-мак. Коксуващи - въглища се нагрява до 1000 ° С без достъп на въздух. Това дава много други ценни реактиви за органичен синтез и ispol'uet-zable металургичен кокс. Също бензен може да бъде получен от тримеризация на ацетилен върху активен въглен при 100 ° С
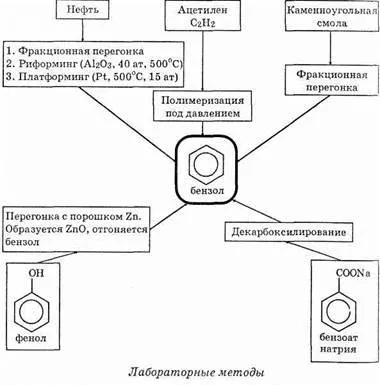
2. лаборатория бензен, разбира се, не са получени, но teoretiches-ки методи за неговия синтез е (те се използват за получаване на нейните производни). И промишлени и лабораторни методи са отразени в диаграмата по-долу.
Управление методи за получаване на бензен
Химичните свойства на бензен
Химичните свойства на бензол се определят, разбира се, неговата р-система. Точно както в случая на алкени, той може да бъде атакуван от електрофилно частица. Въпреки това, в случая на аромат-радикално съединения резултат на такава атака ще бъде доста различен. Висока стабилност на р-система води до факта, че в края на реакцията обикновено е намалена и резултатите, че реакцията не се присъединяват (което ще унищожи
р-система), и електрофилно заместване. Обърнете внимание на детайлите на механизма си.
В първия етап атака AB молекули, съдържащи електрофилно център А, води до образуването на много нестабилна р-комплекс (етап 1). Когато тази система не е ароматна Naru-Шен. Освен това, ковалентна връзка, образувана от един от атомите кол-TSA с частиците А (стъпка 2). В този случай, първо, невалидна връзка A-C, и второ, унищожени р-система. Получената положително заредена нестабилна молекула се нарича S-комплекс. Както вече бе споменато, система р-възстановяване енергично много благоприятно, и това води до разкъсване на С-А (в който случай молекулата се връща към първоначалното състояние) или С-Н (етап 3). В последния случай, етапът на взаимодействие на-ОЗНАЧАВА и получава заместване водород продукт А.
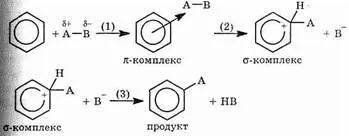
Повечето реакции на ароматни съединения имат само такъв механизъм (електрофилно заместване, но намали-SE). Помислете за някои от тях.
1. Халогени. Среща се само в присъствието на катализатори - Lewis киселини (виж "Теория на Люис.). Задача валцувани каша - поляризация халогенни молекули за формиране на добре електрофилно център:
| АЮЬ 3 + Cl 2 "Cl + [AlSl4] - Полученият частицата има електрофилен атом на хлор, и
Чрез нитриране. Това се извършва със смес от азотна и сярна коте много (нитриращ смес). Реакцията на нитриране смес се случва:
В образуваната хидрогенсулфат нитрониев мощен електрофилно център - нитрониев йон NO + 2. Съответно, реакцията протича, общото уравнение е:
3. Сулфонирането. В концентрирана сярна киселина е равни на равновесие:
В молекулата на дясната страна на остатъка има силна електрофил SO3 Н +. който реагира с бензол. Получено-ал реакция:
Алкилиране по Фридел-Crafts ацилиране. При взаимодействие на бензен с алкил хлориди или алкени в присъствието на Люисова киселина (обикновено алуминиеви халогениди), се получават алкил-заместени бензени. В случай на алкилхалогениди първия етап на процеса:
RSL AlCl3 + «R + [AlSl4] - Във втория етап електрофилна атака частиците R + р-система:
В случай на алкени Люисова киселина поляризира двойната връзка на алкен и въглеродът се отново образува електрофилно център:
Чрез neelektrofilnym реакции включват:
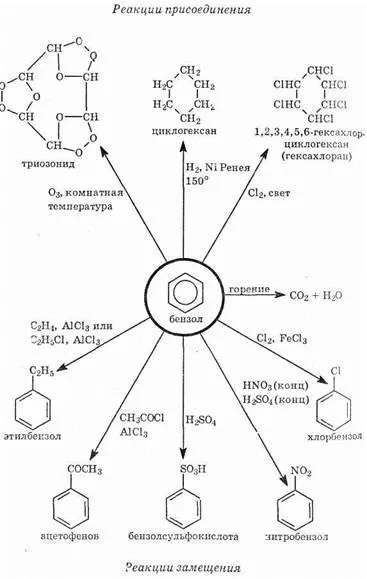
1. хидриране на бензен. Тази реакция протича с система р-унищожаване и изисква тежки условия (високо налягане, темпера-пътуване, катализаторът - платинови метали):
2. радикал хлориране. При липса на Люисови киселини и трудно ултравиолетови лъчи бензен може да реагира с хлор-цистерна с радикал механизъм. Така унищожаване etsya система и р-хлор адукт, образуван - hexachloran твърдо вещество, което преди това се използва като инсектицид:
Номенклатура и изомерия Arenes
Всички арената може да бъде разделен на два реда. Първият ред - бензенови производни (толуен, дифенил): втори ред - CON-кондензира (полиядрени) игрището (нафтален, антрацен).
Да разгледаме бензен хомоложна серия, тази серия от съединения имат обща формула Cn H2N 0.6. Структурните изомери на зелена Хомологична серия от бензол поради RD заместителите взаимното разположение в ядрото. Монозаместен бензенови производни не са позиционни изомери и всички атоми в бензолното ядро са еквивалентни,
I Група С6 Н5 наречен фенил. Фенил и заместени фенилови групи се наричат арил. По-долу са показани някои бензенови производни:
реакции Схема бензен
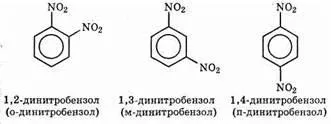
Изомери с два заместителя в позиция 1,2; 1.3 и 1.4 се наричат орто, мета и пара изомери:
номенклатура ароматни
По-долу са имената на някои ароматни Кон-neny:
С6 Н5 NH3 + Cl - Fenilammony хлорид (анилинови хлорид)
Sa H5 СО2Н benzenecarboxylic киселина (бензоена киселина)
С6 Н5 CO2 С2 Н5 benzenecarboxylic киселина етил естер (етил бензоат)
С6 Н5 СоСЬ Benzolkarbonilhlorid (бензоил)
С6 Н5 CONH2 Benzolkarboksamid (бензамид)
С6 Н5 CN бензенкарбонитрил (бензонитрил)
С6 Н5 СНО Benzolkarbaldegid (бензалдехид)
Тези имена отговарят на номенклатурата IUPAC. В скоби са традиционните наименования, които са все още широко разпространена и доста приемливо.
Заглавие бензеново производно с два или повече E-заместител в бензеновия пръстен е конструиран по този начин. въглероден атом от бензеновия пръстен, към който е свързан заместителят, намиране-schiysya най-близо до горната част на списъка по-горе, получава номер 1. Следващ въглеродни атоми на бензеновия пръстен са номерирани, така че lokant - брой на втори заместител - е най-малката.
3 gidroksibenzolkarbonovaya киселина (3-gyadroksibenzoynaya киселина)
Карбоксилната група се разглежда като основен изпълнител, и се определя lokant "1". Номерирането на пръстена е конструиран така, че хидроксилната група имаше малък ( "3" вместо "5") lokant.
Aminobenzolkarb 2-алдехид (2-аминобензалдехид)
-СНО група се счита за основен. Тя получава lokant "1". Група-NH2 е в положение "2", а не "6". В допълнение, е допустимо да се име-аминобензалдехид.
1-бромо-2-нитро-4-хлоробензен Тези групи са изброени по азбучен ред.
Получаване на алифатни въглеводороди. При преминаване SRI алкан с права верига, имаща най-малко 6 въглеродни атома за молекула върху нагрята платина или окси-къща хром (III) се появява дехидроциклизация - образуване арен с отделянето на водород. Например:
2. дехидрогенирането на циклоалкани. Реакцията се провежда при около емисията на пара-циклохексан и неговите хомолози над нагрява платина:
|. бензен Получаване тримеризация на ацетилен. Чрез Н. D. Zelinskogo и BA Казан бензен може да бъде получен чрез преминаване през ацетилен се загрява до 100 ° С с активен въглен тръба. Целият процес може да се представи чрез схемата:
4. Получаване на хомолози на бензен от Friedel-Crafts (вж. Химичните свойства на бензол).
5. Fusion соли ароматна киселина с алкален: С6 H6 -COONa + NaOH ®C6 H6 + Na2 CO3
Arena използва като химическа суровина за производството на фармацевтични продукти, пластмаси, бои, пестициди и много други органични вещества. Широко използвани като разтворители арена.
Реакцията на дехидрогениране може да използва въглехидрат масло доставки за няколко бензенови въглеводороди. Те AUC-свързващ за комуникация между различни въглеводородни групи и при взаимно ги превръща в един от друг.