Надуване на топката водородът
Надуване на топката водородът
Водород - газ е изключително светлина - е 14 пъти по-лек от въздуха и половината от теглото на хелий. Ако те се издуват гумена топка, той ще лети нагоре. Това свойство на водорода, използван в миналото за пълнене на балони и дирижабли.
Днес ние ще произвежда водород чрез химически средства от лесно достъпни материали и принуди топка движение.
Ние проучени няколко начини за производство на водород, чрез химична реакция. При избора, ние изхожда от наличието на наличните реагенти и сигурността. И най-лесният начин да се получи водород в дома - реакция на алуминий, меден сулфат и храна сол във вода (Al + CuSO4 + NaCl + Н 2О).
За експеримента, ние се нуждаем от следното оборудване: пластмасова бутилка от 1 литър, капкомер (на разположение по всяко аптека за пени), меден сулфат (в домакинствата стоки в отдел на тор за растения), сол, алуминиев храна фолио (или алуминиева тел), надуваема топка.
В задръстване на пластмасова бутилка на нагрята плоча с ноктите на удар. В отвора поставете пластмасова съединител на капкомера и лепило (ние използвахме супер лепило). След това сложи на капкомера на съединителя тръба. Гъстата края на капкомера отрязани, както е показано на фигурата. На него ще се постави гумена топка.
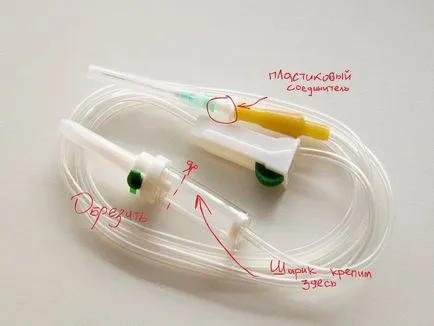
В литра пластмасова бутилка излива равно количество меден сулфат и храна сол (100 g, соли доколкото е възможно).
След това се пълни с вода (700 мл) и се разбърква до пълно разтваряне.
Разтворът се оцветени в ярко зелен цвят.
След това трябва да се подготви алуминиево фолио бучки на храна (като размер, както е лесно и бързо да премине в гърлото на бутилката). Ако има алуминиева тел го използвате (около два метра алуминиев проводник зигзагообразни пъти, за да получите един куп лесно да се изкачи в бутилка). Използвали сме и двете, и др.
Бутилката с разтвор на меден сулфат и соли, за да се постави предварително в контейнер с вода (тиган или кофа). Тъй като по време на бутилката реакционната ще бъде горещо и може да се стопи. (Също, разтворът може да се вари бързо без охлаждане и скочи, преди да затворите щепсела. Тестван!).
След това те хвърля в бутилка от тел и фолио, и са готови да затворете капака с една тръба. Това трябва да стане бързо, тъй като реакцията започва незабавно и водород започва да се открояват веднага.
Ние гледане водородни мехурчета образувани около множество от алуминий. Над повърхността на разтвора се вижда бял дим пара. В реакцията голямо количество топлина и нагрява ни бутилка. С течение на времето, цветът на разтвора се променя към по-тъмен, а след това напълно се превръща в черно. алуминиев оцветени в бучки ръжда-оранжев цвят. Това означава да ги мед от разтвор на меден сулфат.
Чрез отвора на пробката в тръбата, водород влиза в топка. Лампа постепенно напълва с водород и след 10-20 минути реакцията е вече видима като се издига във въздуха.
Забележка: За това, че топката трябва да бъде по-лесно напомпани с водород преди началото на експеримента му участък, т.е. надува и спада многократно.
Как работи (химическа реакция):
Алуминий - активен метал. В чиста форма, реагира с вода, разтваря се в него, водородът се освобождава. Но ако се хвърлят на алуминия във водата, не се наблюдава реакция. Защо. И всичко това заради филм алуминиев оксид е защитена. За реакцията започва да бъде унищожен този филм. Под действието на меден сулфат (CuSO 4) + хранителна сол (NaCl), тази оксид филм се разрушава и алуминий реагира с вода за образуване на водород Н2 и алуминиев хидроксид, Al (ОН) 3.
Меден сулфат и натриев хлорид се образува комплекс. Разтворът става ярко зелено.
2) Полученият меден хлорид CuCl 4 разрушава алуминиев оксид филм.
Това се случва, алуминий реагира с вода, за да се освободи газ водород (Н2).
1) + CuSO4 4NaCl<=> Na2 [CuCl4] + Na2SO4
Меден сулфат и натриев хлорид се образува комплекс. Разтворът става ярко зелено.
2) Полученият меден хлорид CuCl4 разрушава филм алуминиев оксид.
3) 2AL + 6 H2O = 2 Al (ОН) 3 + 3 Н2 ↑
Това се случва, алуминий реагира с вода, за да се освободи газ водород (Н2).