Molecularity елементарни реакции
Basic (прост), наречена реакция се провежда в една единствена стъпка. Те обикновено се класифицират чрез молекулно - броят на частиците, които според експериментално установения механизъм реакционната участва в начално действие на химическо взаимодействие.
Мономолекулни - реакции в които има химична конверсия на една молекула (изомеризация, дисоциация и др ...):
Бимолекулярен - реакция начално действие, което се извършва при сблъсък на две частици (еднакви или различни):
Тримолекулен - реакция начално действие, което се извършва при сблъсък на три частици:
Реакциите на молекулна повече от три неизвестни.
За елементарни реакции се извършват в подобни концентрации на изходните материали и реда на величини на реакционната съвпадат молекулното. Въпреки това, не добре определена връзка между концепциите на молекулярната и реакционната за не съществува, тъй като реда на реакцията, характеризиращ се с кинетична уравнението на реакцията, и молекулното - реакция механизъм.
сложни реакции
Комплекс наричат химични реакции, проявяващи се в повече от една стъпка. Да разгледаме като пример на комплекс реакционни кинетика и механизъм от които са добре проучени:
Тази реакция е реакция на втори ред; кинетичната си уравнение е както следва:
Изследване на механизъм реакция разкри, че тя е на два етапа (два етапа протича в):
V1 на скоростта на първия етап е много по-голяма от V2 скорост на втория етап и като цяло скоростта на реакцията се определя чрез бавно стъпка скорост, така наречените ограничаващ скоростта или.
В заключение, е реакцията на устройството или комплекс, може да се основава на резултатите от проучване на неговите кинетика. Реакцията е сложна, ако експериментално определените частични поръчки реакционни не съвпадат с коефициентите на изходните материали в уравнение стехиометрично реакция; частен комплекс реакция може да бъде фракционна или отрицателен, може да включва не само концентрацията на изходните материали в кинетична уравнение е сложна реакция, но реакционните продукти.
Класификация на сложни реакции
Последователност се нарича сложни реакции, проявяващи се по такъв начин, че веществата, произлизащи от един етап (т.е., продуктите от тази стъпка) са изходни материали за друг етап. Схематично, реакционната последователност може да бъде представена както следва:
Броят на стъпки и материали включени във всеки етап може да бъде различен.
Наречен паралелни химични реакции, в които същите изходни материали в същото време могат да образуват различни реакционни продукти, например две или повече изомери:
Конюгат комплекс, наречен реакцията протича, както следва:
където един от реакциите може да се осъществи независимо, а другият е възможно само ако първата. Вещество, което е общо за двете реакции, е известен като участник. -induktor веществото. вещество D, взаимодействащ с А в присъствието на само първата реакция + акцептор. Например, бензен във воден разтвор на водороден прекис не се окисляват, но се среща в превръщането на фенол и дифенил добавяне на Fe (II) соли. Механизмът на реакцията е както следва. В първия етап на образуването на свободни радикали
който реагира с Fe2 + йони и бензол:
Fe 2+ + OH • -> Fe 3+ + OH -
Също така се появява рекомбинация на радикали:
по този начин И двете реакции протичат с общ междинен свободен радикал OH •.
Ефект на температурата на постоянна скорост на реакцията
Константата на скоростта на реакцията е функция от температурата; повишаване на температурата обикновено се увеличава константата на скоростта. Първият опит да се вземе предвид влиянието на температурата е направено от Van't Hoff, който формулира следното правило:
Когато температурата се повиши при постоянна 10 градуса всеки елементарен скорост химическа реакция се увеличава от 2 - 4 пъти.
Стойност, показващ колко пъти постоянна скорост се увеличава, тъй като повишаването на температурата на 10 градуса, има температурен коефициент на скоростта на реакцията постоянно у на. Математически Van't Hoff правило може да се запише по следния начин:
Въпреки Van't Hoff правило се прилага само в тесен температурен диапазон, тъй като коефициентът на температура у скоростните реакция по себе си е функция на температурата; при много високи и много ниски температури γ става равна на единица (тоест, скорост на химична реакция става независима от температура).
Очевидно е, че взаимодействието между частиците се извършва, когато те се сблъскват; Въпреки това, броят на колизии на молекулите е много голям и ако всеки сблъсък води до частици химични взаимодействия, всички реакции протичат почти мигновено. Арениус постулира, че молекулите на сблъсъка ще бъдат ефективни (т.е. ще доведе реакцията) само ако сблъсък молекули имат някои резервна енергия - енергията на активиране.
енергията на активиране е минималната енергия, която трябва да молекули, които им сблъсък могат да доведат до химична реакция.
Помислете по пътя на някои елементарни реакция
Тъй като химическа реакция на частиците поради прекъсването на старите химични връзки и образуването на нови, се смята, че всеки елементарни реакция протича чрез образуване на нестабилен междинно нарича активен комплекс:
Образуването на активирания комплекс винаги изисква разход на определено количество енергия, което се дължи, от една страна, отблъскване на електронните черупки и ядрата частици подход и, от друга страна, необходимостта от изграждане на определена пространствена конфигурация на атомите в активирания комплекс и преразпределение на електронната плътност. По този начин, по пътя от първоначалното състояние на крайния системата трябва да преодолее един вид енергийна бариера. енергията на активиране е приблизително равна на средната енергия излишък от активиран комплекс над средната енергия на реагентите. Очевидно е, че ако напред Реакцията е екзотермична, активиращата енергия ЕА на обратната реакцията е по-висока от ЕА директна реакция активиране на енергия. енергии активирането на предна и задна реакции са свързани един с друг чрез промяната на вътрешната енергия по време на реакцията. Горното може да се илюстрира с енергия диаграма на химическа реакция (фиг. 2.5).

Фиг. 2.5. Енергийният диаграма на химическата реакция. Eiskh - средна енергия на частиците на изходните материали, Eprod - средната енергия на частиците на реакционните продукти.
Тъй като температурата е мярка за средната кинетичната енергия на частиците, повишаване на температурата води до увеличаване на дела на частици, чиято енергия е равна на или по-голяма от енергията на активиране, което води до увеличаване на константата на скоростта на реакция (Фигура 2.6):
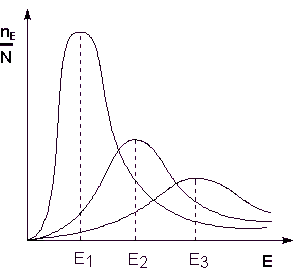
Фиг. 2.6. Разпределението на енергия на частиците. Тук Ne / N - фракция от частици с енергия Е; Ei - средна енергия на частиците при температура Ti (Т1 Да разгледаме термодинамична изход израз, който описва зависимостта на константата на скоростта на реакция на температурата и енергията на активиране - Арениус уравнение. Според isobars на Уравнение на Вант Хоф, Тъй като константа на равновесие е съотношението на скоростните константи на предна и задна реакции може да бъде пренаписана като експресия (II.31), както следва: Представяне на изменението на енталпията на реакция на ΔHº като разликата на две стойности Е1 и Е2. получаваме: Тук, C - постоянен. Постулира, че С = 0, ние получаваме уравнението на Арениус където EA - активиране на енергия: След неопределено интеграция на изразяване (II.35) получи Арениус уравнението в неразделна форма: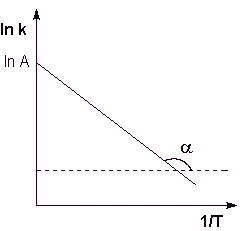
Фиг. 2.7. Логаритъм на постоянна скорост химична реакция срещу взаимното температура.
Тук A - константа на интеграция. От уравнение (II.37) не е трудно да се покаже физическото смисъла на предварително експоненциален фактор А, което е равно на постоянна скорост на реакцията при температура, която се стреми към безкрайността. Както се вижда от израза (II.36), логаритъм на константата зависи линейно от реципрочната стойност на скоростта на температура (фигура 2.7); EA стойност на енергия активиране и предварително експоненциална дневник фактор А може да се определи графично (наклон на права линия на абсцисата и ординатата на пресечната линия).
Познаването на активиране енергия на реакцията и константата на скоростта при всяка температура Т1. на уравнението на Арениус може да се изчисли константите на скоростта, при всяка температура Т2: