Методи за изследване на термодинамични процеси

Начало | За нас | обратна връзка
В изследването на всички процеси се разглежда като равен на пролетта и обратимо.
Преди да се разгледа процедурата за проучване на термо-динамичен процес, ще се въведе петия параметър състоянието на газа - ентропията S. Ентропията характеризира посоката на потока на топлообмен между системата и външната среда.
За произволно маса газ G (кг) на ентропията S измерва в кДж / К и 1 кг газ ентропията означени с буквата S и измерен в кДж / (кг • K), т.е. в същите единици като маса топлинен капацитет.
В термодинамиката, промяната на ентропията се определя само # 916; S = S - С. В това отношение, обикновено се счита, че при 0 ° С, и по всяко ентропията налягане S, както и вътрешната енергия и е равна на нула.
Без помощта на висша математика, за про-свободен стил (политропно) термодинамичен процес може да се запише:
където # 916; Q - количество топлина, участващи в всеки елементарен термодинамичен процес, кДж / кг;
# 916; S - ентропия промяна в този елементарен процес, кДж / (кг # 8729; K).
отношение # 916; р / Т се нарича намалява топлината и представлява качествена характеристика на топлина процес на преобразуване.
Промяната в ентропията като функция на състоянието не зависи от пътя на потока на процеса (т.е., преходът работна течност) и началните и крайните страни,
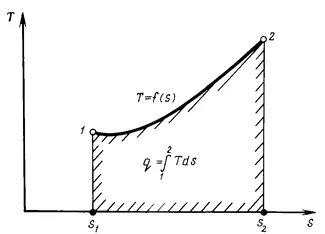
Въвеждане на концепцията на ентропията като параметър на състоянието Rabo което тяло позволява да се прилага за проучване термодинамична-радикално обработва нов (PV-диаграма въведени по-рано) директно въглища-T координатна система, S, в която абцисата в подходящ мащаб определя ентропията S, и аксиалния ординатата - абсолютна температура Т. Тази диаграма се нарича ОЗНАЧАВА-Ts-схема (фигура 1.6.).
В тази схема, зоната, ограничена по - комплект, понижава по абсцисата на точките на първоначалните и крайните състояния, а абцисата изразява броя на докладвани или отнемане на топлина р. Следователно Ts-диаграма се нарича също термично или ентропията. Както в уравнение (1.54), температурата Т - стойност е винаги принудително ЛИЗАЦИЯ, на # 916; и и # 916; р имат един и същ знак, т.е. Q ако топлината се подава към газ (положителна стойност), след това # 916; S увеличава. Обратно, ако # 916; Q е дадено (отрицателна стойност), след това # 916; S намалява. Това е един от най-важните свойства на ентропията.
дефинирани lyayut в изследването на термодинамични процеси:
1) уравнение на процеса и неговото графично изображение в координатната система на р, V,
2) връзката между основните параметри на състоянието на газ;
3) промяна във вътрешната енергия на газа # 916; ф и стойността на работата на разширяване л;
4) Количеството топлина Q, действаща на газ или изтеглени от него;
5) картина процес в координатна система T, S.
Процес срещащи се при постоянен обем се нарича изохорен. Изохорен процес се отнася, по-специално, когато изчисляването на теоретичния цикъл МОТОР teley карбуратора на двигателя с вътрешно горене (ДВГ). уравнение процес
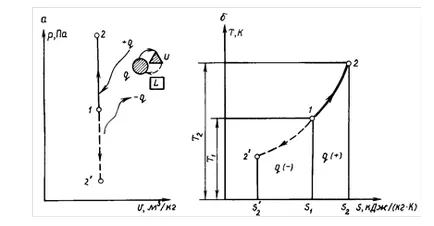
В PV-анаграма (фиг. 1.7) графиката на процеса е права линия, перпендикулярна на абсцисата и нарича isochore.
При постоянен обем # 916; # 965; = 0 площ, отговаряща на # 961; # 965; -diagram за разширение L. Също така е нула. Следователно, в изохорен процес на разширяване на газа работа L = 0.
Връзката между параметрите на газ промяна определят от уравнението (1.13), записани за начална и крайна L 2 (виж фигура 1.7, а ..) членки:
Разделяне на срока по план, ние получаваме
Уравнение (1.56) показва, че изохорен налягането на технологичен газ е пряко пропорционална на абсолютната темпера-кръг.
Тъй като в процеса л = 0, тогава съгласно уравнение (1.48) на работния флуид доставя напълно консумира в промяната на вътрешната енергия на топлина Q:
В 1-2 процес "(вж. Фиг. 1.7, а) р топлина се отстранява от газа, като по този начин намаляване на температурата. Conse- ствие процес с 1 - 2 '- охлаждане на работния флуид (- р).
Промяна на специфичната ентропия # 916; S = S - С. в изохорен процес (топлинна мощност при постоянна C) Брой с формула
където # 916; S - ентропия промяна на газа, кДж / (кг • K); С - средния топлинен капацитет на масата газ в процеса, когато V = пак там; Т. Т; е температурата в началото и в края на процеса, К.
Уравнение (1.59) показва, че изохорен процес е представен в координати Т, е логаритмична крива (виж Фигура 1.7, б ..) и потоци, така че въвеждането на топлина (+ р) увеличава ентропията и температурата на газа, и отвеждане на топлината (- р), този параметър намалява.
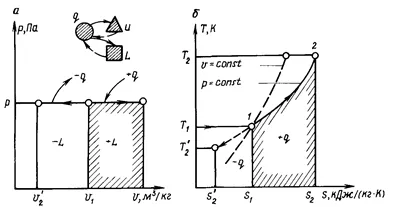
Процес, протичащ при постоянно налягане се нарича изобарен. Такъв процес може да прояви термодинамична-тек в цилиндъра, буталото на което се премества без триене, така че налягането в цилиндъра е постоянна и равна на налягането в околната среда буталото.
(. Фигура 1.8) В PV-диаграма Isobar е права линия, паралелна на оста х (оста на специфични срещу обеми):
С 1 - 2 - с топлоснабдяване (+ р), и 1 - 2 '- с отвеждане на топлина
Връзката между стойностите на основните променливи
параметри на състоянието работен флуид се определя от уравнението Clapeyron (1.13), записани за точките 1 и 2:
По този начин, чрез увеличаване на специфичния обем на газа в изобарен процес, температурата се повишава, за специалиста-shenii - намалява.
работа на разширяване на газа л (.. виж Фигура 1.8, а), представено с площ под линията на процес с 1 - 2 - разширяване (+ L) и на линията с 1 - 2 '- компресия (- л). Фиг. 1.8, и е ясно, че работата на разширяване може да се определя от уравнението
Ако количеството на газ, за да определи G (кг), формулата за изчисляване на работата на разширяване става L
Като във формула (1.63) разликата на абсолютните температури Т - Т = 1 К, ние получаваме че L = R. Това прави възможно да се определи физически смисъла на специфичната газова константа като работата на разширяване на 1 кг идеален газ, когато се нагрява при 1 К р = пак там.
Промяната на вътрешната енергия на идеалния газ при температура стойности добре известно-ционни в началото (Т) и край (Т) protses-ва (приемайки постоянна специфична топлина С) се изразява чрез уравнение-niem
Количеството топлина, предоставени от работния флуид в процеса се определя от математически израз термодинамично първия закон (1.48) с уравнения (1.63) и (1.65):
като съгласно формула (1.30) C = + R.
Промяна на специфична ентропията в изобарен процес при четене от уравнението
Следователно, Ts-диаграма изобарен процес, както и изохорен изобразена логаритмична крива, но по-плитка в сравнение с isochore (вж. Фиг. 1.8, б). Такова относително местоположение Isobar и isochore в TS-диаграма дължи на факта, че специфичната топлина C>.
Количеството топлина Q изобразява графично процес Xia област (виж фигура 1.8, б ..), определена от процес на крива (1 - 2 1 - 2 ') и оста на абсцисата.
В процеси, свързани с изчисляването на котелни, парни турбини, както и сушенето и икономическо производство параметър охлаждаща селски използва работен флуид състояние (газ), наречен енталпия - teplosoderzha-niem. Специфична енталпия обозначен с часа и се измерва в кДж / кг. Въвеждането на понятието "енталпия" в допълнение към предварително обсъдени (налягане, специфичен обем, темпера-тура, вътрешната енергия, ентропията) п, о, Т, U, и улеснява изследването на процесите в топлинни двигатели, особено в парни турбини.
Това състояние настройка е
Ако в (1.68) и заместител PV и техните стойности, а именно Т = С и PV = RT, получаваме
Ето защо, енталпия на идеален газ е числено равна на произведението от специфичната топлина при постоянно разделение масово да се предотврати от абсолютната температура. Концепцията за "енталпия" може да даде следното обяснение. Да предположим, че в цилиндъра под буталото е 1 кг газ. Сложете на буталото топ натоварване тегло G, балансиране р газово налягане.
където F - площ на буталото.
Цялата система е в равновесие. В този случай енергията на системата (1 кг газ и товара) е равна на вътрешната енергия и на газа и потенциалната енергия на маса от G, повдигнат на височина Н, равна на височината на цилиндъра:
Тъй като FH = ф (т.е. 1 кг обем газ в цилиндъра), общата енергия на системата и е равна на + PV = Н - голямата газова енталпия.
Топлинната изчисляване обикновено е необходимо да се знае, промяната на енталпията
(# 916 Н = Н - з), а не неговата абсолютна стойност. Ето защо, за произхода
(0 К или 0 ° С) за крайния резултат (# 916; з) не е от значение.
С помощта на уравнението (1,48) е лесно да се покаже, че за всеки газ в процеса при постоянно налягане (изобарно, р = пак там) въвеждане на топлина се равнява на разликата в енталпията в края и в началото на процеса:
или съгласно (1.68)
Следователно, в изобарен процес обобщи количеството топлина солна определя от разликата в енталпията на край (Н) и началото (з) на процеса.