Метан молекула - позоваване химик 21
Химия и инженерна химия
Течен метан молекула не съдържа хидроксилни групи. не се държим заедно. Те са лесни за да разпръсне, образувайки газ. Дори при такава ниска температура. както -161 ° С, достатъчно топлина за изпаряване на метан - просто температура на кипене -161 В. метилов алкохол молекули съдържат хидроксилни групи. че да ги направи лепкава. С цел да се отделят един от друг и да се превърне в газ, е необходимо да се харчат много енергия, въпреки че молекулата е само малко по-голям от метанови молекули. Ето защо температурата на кипене на метанол 65 "С - 226 градуса по-висока от тази на метана [c.86].
Рекламации предлагат големи възможности за пряко изучаване на механизма на химичните реакции. Както изотоп може да се прилага както стабилни и радиоактивни изотопи. Обикновено, в молекулата на изпитване е белязан (т. Е атом се заменя със съответния радиоактивен изотоп или стабилна) специфичен атом (този, който се подлага на изместване) и изследвана неговото превръщане в реакцията. [C.369]
Страничната верига на това съединение се състои от въглеродни атоми и прикрепен към него три водородни атома. С други думи, не е просто молекула метан без един водороден атом. Такава група се нарича метилова група. съединение, състояща се от [c.58]
Да започнем с нещо по-просто. Си представим, че всички водородни атоми в молекулата на хлорни атоми заместен метан [c.68]
Това определя образуването на четири С-Н връзки и местоположението на молекули от водородните атоми в метан CH4 върховете на тетраедър (фиг. 50). [C.72]
Фиг. 121. Схема образуване на връзки в молекулата на метан.

Сравнете вашия модел с фиг. III.8. Метан молекула трябва да бъде под формата на триъгълна пирамида (с триъгълни пирамиди в долната част) (Фиг. [C.188]
Фиг. III.9. Метан молекула има (yurmu тетраедър.
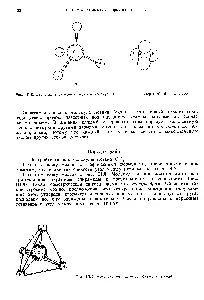
Таблица. 111.3 също са дадени имената на първите 10 членове на серията балкан. Имената състоят NZ корен с добавяне на затваряне. Root показва броя на въглеродните атоми в молекулата. Met - означава един въглероден атом. етаж - две реквизит - три и т.н. [C.189]
химичната връзка в молекулата на метан. CH4 управлява добре обяснено въз основа на представяне на четиристенните часа -Hybrid орбитали въглеродни атоми. Тези възгледи също дават възможност да се обясни структурата на етан, MNS. и много други органични съединения. в която въглеродните атоми са свързани един с друг чрез единични връзки във веригата. В етан на всеки от два въглеродни атома, свързани чрез три водородни атоми за образуване на ковалентни връзки. включващи три от ВП четири хибридни орбити. Четвърти час орбитален всеки въглероден атом се използва за образуване на ковалентна връзка с друг атом на същото. Припокриване -Hybrid р орбитали на двата въглеродни атома, води до стабилно свързване молекулни орбитали и antibonding орбитали нестабилни. Свързваща орбитален, симетрично около ос С-С е напълнен орбитални и два електрона със сдвоени завъртания. [C.565]
Въз основа на данните, събрани клас определят алкан моларен топлина на изгаряне от един въглероден атом в молекула (метан) и осем (октан). [C.206]
Използване на езика на локализирано теория връзки, да кажем, че метан СН молекула проведе интегрално там на разположение чрез четири еквивалентни единична СН връзка. Ако такова представяне е правилна, топлината на разлагане на метан на изолирани въглеродни и водородни атоми трябва да бъде четири пъти повече енергия С-Н връзка. (Въпреки че в действителност в бъдеще навсякъде означава енталпията, ние ще използваме една обща, макар и неправилно терминология, и ние приемаме, че получените стойности на енергията на свързване. Вместо да енталпия взаимоотношения. Разликата между числовите стойности на енталпията и енергийни връзки на толкова малки, че е в рамките на точността на подход, който е насочен енергия на локализирани връзки.) [C.26]
Трябва също да се отбележи, че има преразпределение на енергията на свързване на радикали. По този начин, енергията се счупи връзките в молекулата на метан и следните радикали [c.282]
Софтуер. Дайте възможно най-много доказателства, показващи равностойност на всички връзки в молекулата на метана. [C.30]
Вече каза, че молекула на метан без един водороден атом е наречено метилова група. Същото важи и за всеки въглеводород. Етан без един водороден атом на етиловата група се нарича. По същия начин, образува пролил група, Bu-вършеене, изобутил и така нататък. [C.72]
Въпреки това, пълното име може да ни каже нещо, което не може да се каже, намалена. От това става ясно, как изглежда молекула. На първо място. завършва на metilmetan - това означава, че трябва да започне с молекулата на метан и прикрепен към него метилова група. Трихлоро означава, че три от водородните атоми в молекулата трябва да бъде заместен с хлор. След името трябва да бъде. че два водородни атома са заместени с хлорофенил група, т. е. в бензеновия пръстен. във всеки от които липсва един водороден атом и един от водородните атоми са заместени с хлор. Това е всичко. [C.75]
Energeticheskgya диаграма орбитали метан молекула е показано на фиг. 45. спокоен глас молекули CH4 има две свързване и две antibonding енергийни нива. Разпределение осем валентните електрони метан молекули (четири от четири въглеродни атома и атомите на Н-работа), съответстващи на електронен конфигурация [c.63]
Молекулата се характеризира с относително високо метан и др NOSTA. При нормални условия, метан е активно (с експлозия на) грах giruet с флуор, хлор много бавно vzaimodeystpuet едва реагира с бром. Реакцията с хлор или бром ryaetsya изразят проверка по светлина. и когато pagrevanni и се състои в последователно заместване на водородни атоми с халогенни атоми на произволна форма халоген, например [c.467]
Изгарянето на метан ще настъпи съединение него с кислород в образуването на нови продукти. Това е кислород, метан комбинира с въглерод. форма въглероден диоксид и съединение с водород даде вода. Така за един изгаряне на метан молекули изискват две или четири молекули на кислороден атом, а именно, за да се превърне въглерод в СО2 трябва odpa молекула кислород. и за превръщането на четири Atemov водород в Н 2О се изисква също една молекула кислород. общо четири кислородни атоми. За допълнителна формула изчисление Thornton [c.68]
Над представихме традиционните понятията на квантовата химически хибридизация на атомна орбитала на конвенционални примери (CO2, HC CH, H2C == СН2, СН4, SAS, и така нататък. D.). Въпреки това, тези идеи, които с право може да се нарече класически, а в някои случаи, не са приложими. Един от тези случаи е една молекула, б-dikarba- / слой ZO-geksaborana (фиг. 36), където четири въглеродни валентността AO достатъчно, за да се изгради пет ортогонална GAO. Въпреки това, в случай на повреда на изискването за ортогоналност, както е показано S. G. Semenovym, е възможно да се конструира линейно зависими комплект-neorto SYH-диагонал се превръщат един в друг чрез операции на симетрия Ots1- Това 15 SYH (6 две център, локализиран в MV или HV 8 връзки три-център са локализирани на връзките и един chetyrehtsentrovaya CSAS, идентични канонични 2г-1 М0 възприемане борни атоми) с електронни occupancies 2 не може да бъде превърнат в единна трансформация каноничен източник MO 13 (сравни със случая обсъдено по-горе метан молекула). [C.216]
Метан, СН4, е еквивалентен на четири водородни атоми. прикрепен към централния въглероден атом. За съединения с четири водородни атоми на въглероден необходимо да се използват всички валентните орбити. Чрез хибридизация един 2s и три 2p орбитали могат да получат четири еквивалентни 5р -Hybrid орбитален (фиг. 13-5). Всеки от 5P -zu bridnaya-орбитална има една четвърт от 5-герой и три четвърти от област характер. И четиримата орбитална билото насочени към ъглите на регулярна тетраедър. така орбиталната билото понякога се нарича тетраедъра хибриди. В резултат на това се припокриват всеки -Hybrid часа с орбитален 1х орбитален водородни образуват четири локализирани свързване орбити. Nailuchschee припокриване между орбитали и 1x се получава чрез поставяне на четири водородни атоми в върховете на редовен тетраедър. както е показано на фиг. 13-6 (което показва куб, които образуват променлив пикове посочени върховете на тетраедър). метан молекула осем валентните електрони (четири въглеродни атоми и един от всеки от четирите водородни атоми), които трябва да [c.555]
Да разгледаме като пример каноничните MO метан CH4 молекули (simmetryya ТА) в сближаването на MO LCAO (фиг. 35) [c.206]