Явления в течна среда и за междуфазовите повърхности
Топенето на запоената зона са много важни процеси в течна фаза и в интерфейса.
Фаза във физическия химията на системата се нарича хомогенна, otdelennayaot chasteyvidimymi други интерфейсите.
Фази в svarkiyavlyayutsyagazovaya сряда зона течни шлака zhidkiyitverdy метали.
Сред най-важните процеси в зоната на заваряване трябва otnestivzaimodeystvie течни фази с газове и окиси.
Разтварянето на газове. Да приемем, че система estdvuhfaznaya състояща се от газовата и течната фаза на компонентите на йод в газова фаза може да бъде разтворен в течната фаза.
Химични елементи (газове) могат да създават течен химически съединения или разтвори: в течна фаза реагенти показват молекула или молекулярни йони.
Разтваряне: неутрални атоми (молекули) на разтворими вещества проникват в дебелината на разтворителя и заемат място между атомите и молекулите на разтворителя. Мехурчета.
Между течни и газови фази се разменят газ компонент.
При дадена температура на скоростта на разтваряне на газ в течната фаза може да бъде schitatproportsionalnoy davleniyurv неговия частичен газова фаза,
и скоростта на отделяне на течност -proportsionalnoy kontsentratsiiSv неговата течна фаза.
В равновесие, скоростта на разтваряне е скоростта на отстраняване.
В състояние на равновесие на концентрация газ в zhidkostiS = к * р където к -. Хенри константа, която определя разтворимостта на газ в течност при дадена температура P - парциално налягане на газа в газова фаза, ч (Cipyavlyayutsya концентрации показатели елемент, съответно, в течността и газа. )
Тази връзка е създадена и е наречен закон Хенри Хенри.
закон на Хенри е валидна само при ниска разтворимост, а в случая eslirastvorenny газ, не влиза на течността в химическата реакция.
Това право е приложимо към идеала и разредени разтвори. За всички компоненти (газове и течности) са ограничаващи максималните стойности на разтваряне (условие насищане), които зависят от температурата и по-горе, които течността не приема газ.
В повечето случаи, газовете разтварят в течния метал с повишена граница на насищане vozrastaet.No температура, близка на кипене - намалява. Ако концентрацията на газ в разтопен метал при дадена температура от състояние на насищане, излишъкът започва да престои под формата на газови мехурчета (пори).
Течният метал за разтваряне газове в атомната състояние и тези kotoryeimeyut незапълнени валентните черупки (Н, п) и не образуват връзки с метален йон (например кислород).
Обичайната състоянието на такива молекулни газове е, следователно, преди разтваряне трябва да се подложи на дисоциация,
Право на разпределение на материята в несмесващи се разтворители.
Разглеждане на система, състояща се от две течна фаза и В не са разтворими в един от друг, а третият - газова фаза, един от компонентите, които могат да се разтварят както във фаза и в fazeV. Както може да се запише, че концентрацията на газ във всяка от фазите при същата температура, което означава, според закона на Хенри, че
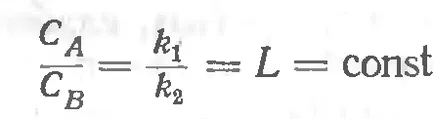
PostoyannayaLnazyvaetsyakoeffitsientomilikonstantoy разпределение, а съотношението е математически разпределението на vyrazheniemzakona Нернст.
Това право е приложимо до вещество, което е във всеки агрегатно състояние, ако той е разтворим в двете контактуване течен разтворител. Формулировката на закона на разпределение е, както следва: Всяка субстанция raspredelyaetsyamezhdu две разтворители, така че kontsentratsiyego съотношението остава постоянна в двете разтворители. Трябва да се има в предвид, chtoesli в два несмесващи се разтворителя odnovremennomozhet се разтвори повече вещества. един от друг не сътрудничи, tokazhdoe от тях ще се разтвори, независимо от другите, които имат постоянен разпределение.
В несмесваем разтворител слят заварка зона две - на течния метал и шлаката.
Способността на някои съединения, разтворени в двете фази, използвани за пречистване на такива метални съединения. Например, когато заваряване стомана в течния метал може достатъчно енергично изгладят obrazovyvatsyazakis влошаване на свойствата на желязо stali.Zakis лесно разтворими не само в течния метал, но също така и в течна шлака, и неговото разпределение между тези две различни свойства на течности е предмет на разпределение право.
Условия за в бъдеще да се заключи, че концентрацията на вещества, присъстващи в шлаката, в скоби, както и вещества, nahodyaschihsyav течен метал, - на площада, можем да запишем
Намаляването на концентрацията на свободен железен оксид в шлаката може да доведе до намаляване на съдържанието му в течния метал: метал ще се премести в шлаката, тъй като за дадена стойност на константата на разпределение на температурата непрекъснато. И въз основа на тази дифузия деоксидиране метал.
По същия начин и може да се намали концентрацията на сяра в метала. От действието на закона на разпределение се основава също така метод за получаване на високо рафинирани електро-шлака претопяване на метали и сплави.
Концепцията за повърхностна енергия.
Различни химични процеси, протичащи в хетерогенни системи, които обикновено започват да растат от повърхностите на разделяне на фазите, след което се движи по-нататък навътре в системата.
Условия за съществуването на молекулите на повърхностния слой, са различни от тези, в които молекулите са вътрешни слоеве. Поради това, свойствата на повърхността се различават от свойствата на вътрешните слоеве материал.
Характеристики свойства на повърхностните слоеве на веществото са показани на всеки от интерфейса, но
особено много - в "течност - газ" система,
слабите - на границата на две несмесващи се течности, както и в "твърдо вещество - течност"
още по-слаби - на границата между твърди частици.
Проявата на тези свойства са резултат от наличието на определена секция на повърхностната енергия на фазите - повърхностна енергия, или напрежение energiipoverhnostnogo.
Повърхностното напрежение зависи не само от течността, но също и върху околната среда, която е в непосредствена близост до него, тъй като тази среда може да повлияе течни повърхностни молекули. Чрез промяна на граничния среда може да бъде много силно повлияна от размера на повърхностното напрежение zhidkosti.Veschestva, че намаляване на повърхностното напрежение се нарича повърхностно активни вещества, както и веществото е слабо засяга повърхностното напрежение -poverhnostno-активна. Например, групата на алкални и алкалоземни метали и повечето от соли, образувани от тях се отнасят елемент и повърхностноактивното вещество veschestvam.Etim използва в запояване и заваряване, с цел да се постигне по-добро омокряне на повърхността на металния течния метал твърдо вещество и по-лесно разтваряне на електрод метални капчици в заваръчната вана.
Повърхностното напрежение се отрази на цифровите стойности на парното налягане и разтворимостта на веществото. Ако течността има формата на капка, капките с намаляване на размера на парното налягане върху тях uvelichivaetsya.Eto поради степента на влияние на кривината на летливи poverhnosti.Otsyuda следва, че малки капчици винаги имат по-високо налягане на парите. от големи и следователно по-лек от въздуха isparyayutsya.Osvezhiteli аерозол.
Що се отнася до действието на повърхностното напрежение на разтворимостта, е известно, че малки капчици се разтварят по-добре от по-големите.
Същото се случва и с твърди зърна от метал: при високи температури едри зърна растат за сметка на малко по-малко стабилен (когато отопляване едри зърна растат за сметка на малките).
Значително влияние върху стойността на повърхностното напрежение има промяна на температурата. Повишаването на температурата води до намаляване на повърхностното напрежение, в резултат на разширяването агент атенюиран сили на привличане между молекулите в вещество, и в повърхностния слой.
При определена температура, повърхностното напрежение на течността става нула и изчезва разпределя между течността и температура газ fazoy.Eta наречен абсолютен точка на кипене или критична температура, над която веществото не може да бъде в течно състояние.
Естеството на адсорбционни явления може да се обясни както следва. Молекули или атоми на веществото се намира на повърхността, са, за разлика от молекулите и атомите, намиращи се вътре в материала, свободен, не заета свързващи сили. Ако такава повърхност ще бъде, например, газ атоми, те могат да се съхраняват молекули или атоми на материала като свободни свързващи сили, т.е.. Е. адсорбира. Ако свързващите сили са достатъчно големи, адсорбирана атом ще остане на повърхността, ако слабите - той може да напусне повърхността на материала.
Повишаване на температурата, при която се извършва адсорбцията поради увеличената енергия на термичните вибрациите на частиците адсорбираните води до някои от тях обратно в газовата среда, и адсорбция се намалява.
Понижаването на температурата, напротив, vyzyvaetvozrastanie адсорбция докато повърхността се образува тънък слой от газ няколко молекулни слоеве.
По същия начин, за развитието на адсорбция ефект и понижаване на налягането: понижаване davleniyaadsorbtsiya намалява.
Когато налягането се увеличава адсорбционни увеличава.
В допълнение към температура и налягане, развитието на процеса на адсорбция е засегната в значителна степен от естеството на адсорбираните вещества и химични rastvora.Iz силна адсорбираните компоненти тези, чиято точка на кипене и температура изпаряване zhidkostvyshe. защото при нормални условия, те са по-малко "активен" (ниска скорост на молекулите).
развитие адсорбция улеснява от присъствието на разтвор на повърхностно активни вещества, които намаляват rastvora.VUS на повърхностното напрежение.
процес на адсорбция отнема много кратко време (от секундата), по-нататъшно движение на повърхността на продукта абсорбира в интериора материал е много по-бавно - поради дифузия или чрез механично смесване.
Концепцията на вискозитета на течности.
Вискозитет или вътрешно триене се нарича съпротивление, упражняван от течната среда чрез преместване на някои от неговите части спрямо другата. Известно е, че при движение на флуида през канала. (Фигура 89.6) Оцени различни слоеве течни не е еднакъв: слоевете в стените на канала ще се движат по-бавно от вътрешния. промяна скоростта на движение на флуида слоеве е описан от параболична крива (Фиг. 89 А).
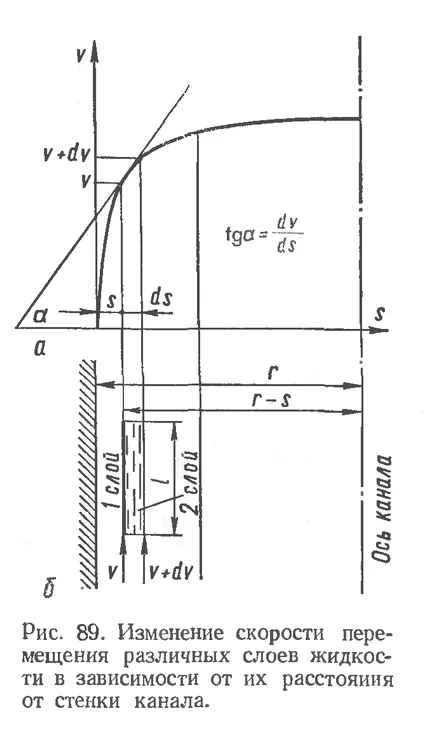
Силата на вътрешното триене между слоевете се определя от следната зависимост (закон на Нютон): устойчивост сила пропорционално на градиента на скоростта на преместване слоеве.
където F - сила вътрешната триенето между sloyamizhidkosti, движещи се с различна скорост, дин;
DV / DS - градиента на скоростта характеризиращи скорост на течни слоеве промяна в посоката, перпендикулярна на тяхното движение, втор-1;
- коефициент на пропорционалност в зависимост от природата, състав и температура на флуида; Той също така yavlyaetsyakoeffitsientomabsolyutnoy вискозитет ilikoeffitsientom vnutrennegotreniya.
Единицата за абсолютни вискозитет течности - поаза (ЗЗ) - приема вискозитета на такава течност, при което силата се движи -пиридин 1cm2 течен слой във връзка с друг такъв слой, разположен на разстояние от първите 1 см, при скорост от 1 см / сек.
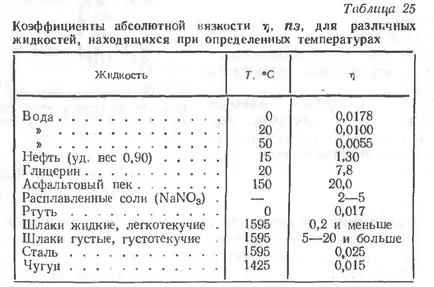
В процеса на заваряване, разбира се, най-голям интерес е вискозитетът на шлаката оформен върху повърхността на стопения метал, като стойността на този показател и естеството на промяната в процеса на заваряване зависи от технологичните свойства на приложните покритието и поток, степента на завършване на металургични процеси, и така нататък. Н.
Вискозитет на течности и шлака заваряване по-специално е много зависи от температурата и обикновено намалява с увеличаване на последната. С повишаване на температурата на шлаката, намаляване на вискозитета, преминават през три характерни състояния:
1 - крехък съответния вискозитет > 13 октомври PZ;
3 - Течлив - в <10 пз.
За да се определи вискозитета на течни шлаки използва уред, наречен вискозиметър.
1. метод топката спад се основава на измерване на скоростта на падане на топката на платина в течната проба. В този случай, коефициентът на вискозитет се определя по формулата на Stokes.
2. Метод за въртене цилиндър има няколко варианти, един от които е измерване на скоростта на въртене на цилиндър течността на пробата чрез действието на специфичен момент. В вискозимер е калибриран на течността, чийто вискозитет е известно (захарни разтвори, глицерол).
Пара всяко вещество се увеличава с повишаване на температурата.
Налягането на парите - парциалното налягане на химически изпарения във въздуха, която е да е в течно или твърдо състояние, е в контакт с въздуха.
Процесът на образуване на пара при температури под точката на топене на веществото се нарича сублимация (сублимиране) над точката на топене - изпаряване.
След изпаряване заедно с освобождаването на частици от течността. пропорционална на броя им върху повърхността на течната фаза, има обратен процес - ги върне от газовата фаза в течността. Следователно opredelennoyuprugosti пари над течността ще отговаря на брояч баланс тези два процеса.
Увеличаването на влага чрез използване овлажнители и аквариуми.
Температурата, при която налягането на парите е равно на налягането на въздуха на околната среда, наречена точката на кипене. Изпаряване при тази температура е вече не само върху свободната повърхност, но през течен обем. Таблица. 26 показва точката на кипене и специфичната латентна топлина на изпаряване при някои елементи.
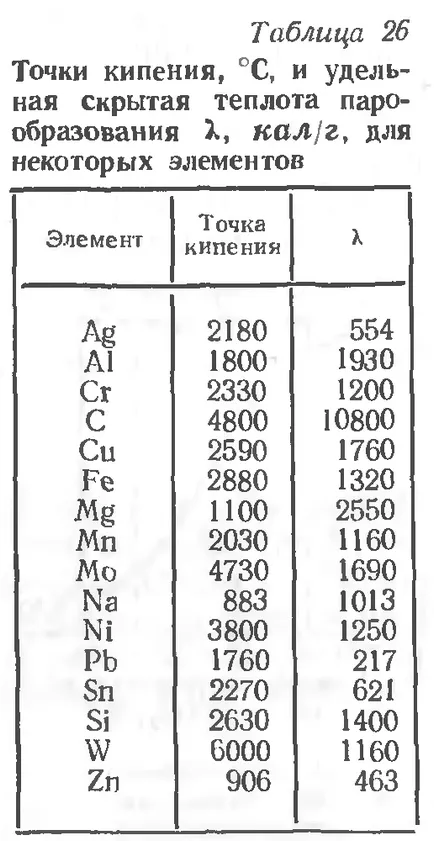
Таблица. От това следва, че някои метали вари при температура, която е характерна за изхвърлянето на дъга. Наличието на метални изпарения в дъга зона (парното налягане) допринася за един от електрод метала за прехвърляне вид на продукта - прехвърляне на метални пари.
Специфична латентна топлина на изпарение е зависима от температурата и налягането. Тази зависимост може да се определи въз основа на законите на термодинамиката. Но вход сложните изчисления и липсата на точните стойности на константи, определящи налягането на парите, които често са ограничени до около приблизителни уравнения изградени въз основа на експериментални данни в продължение на няколко температури.
Топлината на изпарение от твърдо вещество, т. Е. изпаряване или сублимация, равен на сумата от топлини на топене и изпаряване.
Всичко, което е приложено към чисти вещества. явление става много по-сложно за смес от различни вещества.
атмосфера на газ по време на заваряване метална форма, с изключение на компонентите на въздух. двойка метални и химически съединения. членове на покрития електрод или потоци. и продукти от разлагането.
Прехвърляне на метал пара е незначително поради .В условия на висока температура дъга изпълняват всички метали с високо налягане на парите, изглежда, трябва да са в газообразно състояние. Въпреки това, скоростта на изпаряване е ограничен, трансфер метал под формата на капчици чрез разликата дъга е много бързо и поради това по време на варенето на капчиците полет и само частично изпарен.
Загуба на легиране elementovza iokisleniya чрез изпаряване.
Елементи с висока точка на кипене и ниско налягане на парите се изпаряват по-малко интензивен (например, W, Ni).
Обратно, елементи, които имат ниска точка на кипене и високо налягане на парите, се изпарява, а енергично (Zn, К, Na, Са, Mg, Mn, и т.н.).
По този начин, за увеличаване на калций в температура 100-200 ° С води до увеличаване на налягането на парите в стотици. в същото увеличение температура vremyadlya желязото при 300 ° С води до увеличаване на налягането на парите на само 10 пъти.