Изследването на електрическата проводимост на течности и определяне на електрохимичния еквивалент на мед
Целта и Цел: Да се изследва механизма на преминаване на ток в електролита и законите на електролизата електролиза и определение elektrohimicheskogo мед еквивалент.
Вещества водни разтвори, които провеждат електричество са посочени като електролити. За разлика от метали, като електронна проводимост и полупроводников като проводимост електролити електрон дупки имат йонна проводимост.
Понякога се нарича електролити и проводими разтвори самите, въпреки че по-правилно изразяване - електролитен разтвор.
Водните молекули се разпадат до по-малка степен на йоните:
Концентрацията на водородни йони определя киселинността на разтвора, и концентрацията на хидроксилни йони характеризира алкалност на разтвора. В чиста вода, концентрацията на Н + йони и ОН - са равни. Чиста вода дисоциира много слаб. В един мол вода при 22 алкохолни градуса С само разпада в йони мол.
Въпреки това, за да се получи такава вода е много трудно, защото въздух винаги присъства във въглероден диоксид, който се разтваря във водата повишава концентрацията на водородните йони. Тъй като водата има голяма диелектрична константа () и водните молекули имат значително диполен момент (Cl # 8729; т), около водните молекули върху interatomic разстоянията (нм) има сравнително силно електрическо поле. Последното е директна причина, смекчаващи силата на електростатично привличане на йоните в молекулите на разтвореното вещество. Следователно, в процеса на разтваряне на сол или алкални сблъсъци поради термично разлагане на молекули става в аниони и катиони. Ако молекулите на разтвореното вещество във вода не се разпадат в йони, разтворът не е проводник. Например, водни разтвори на захари, глицерин - изолатори.
В резултат е образуването на дисоциация солвати (хидрати), където водните молекули "плик" йони за образуване около тях солватиране черупка (Фигура 1).
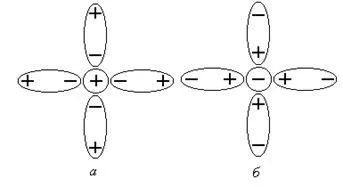
Фигура 1 солватиране черупка - катион; б - анион
За появата на електрическия ток в електролита, трябва да бъде в баня с разтвор на електролит към долните електроди от проводим материал (метал, въглерод и други подобни), към който се свърже източник на ток (виж фигура 2). Такова устройство се нарича галванично или електролит баня.
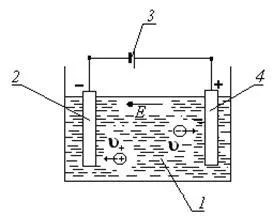
Фигура 2 електролитната вана 1 - разтвор баня
меден сулфат; 2 - катод; 3 - източник на ток; 4 - анод;
и - скоростта на положителни и отрицателни йони
В йон в електролита са две сили: силата на електричното поле сила и движение от съпротивлението на средата. Силата, упражнена от електрическото поле изчислява по формулата:
при което - йон заряд, CI; - електрическа сила на полето.
Force. поради взаимодействието на молекулите около йон е пропорционална на скоростта:
където - коефициент на съпротивление на йони в средата.
При движение на йони в електролита между силите на равновесие е установено бързо и движението на йони между електродите може да се разглежда като единна и праволинейни, така че:
Ако се определи. след това. Коефициентът б се нарича на мобилността на йони. Физическата смисъла на мобилността, че характеризира скоростта на йони в електролита в силата на електрическото поле E = 1.
Тъй като ток в електролита е подредена движение на йоните на двата знака, поради действието на външно електрическо поле, плътността на тока в електролита се определя с израза:
където п + и - - концентрацията на катиони и аниони; + И - - - тяхната дрейф скорост и + - - техните такси.
Като място на катода и анода реакцията на окисляване-възстановителен-ING са обект на закона на Фарадей.
Първият закон. маса еволюира в електрода е пропорционално на изтичане вещества чрез електролита на заряд:
където - електрохимична еквивалент; I - ток, А; т - време с.
Електрохимични еквивалента от някои елементи, показани в Таблица 1.
Таблица 1 Стойности на електрохимически еквиваленти
За някои вещества
Вторият закон. електрохимични еквивалентни елементи са право пропорционални на техните химични еквиваленти:
където F - брой на Фарадей (F = 96500); М - моларен маса еволюира на материала на електрода; N - неговата валентност - химическата еквивалент.
електроокислението или electroreduction Продукти електролитни йони могат да влизат в химична реакция с разтвора близко електрод. Такива процеси са наречени вторични реакции.
Всички тези процеси се използват в различни области на технологиите, много от тях се използват и в медицината.