Химически кинетика 2
Химична кинетика ─ учението на законодателствата на химични реакции. Кинетика се обмислят две важни и взаимосвързани характеристики на реакция: скоростта и механизъм, познаването на което ви позволява да контролирате реакции, изберете оптимални условия за възникването им.
2.1 Скоростта на химични реакции
скоростта на химична реакция, се определя от броя на колизии взаимодействие активни частици срещащи за единица време за единица обем (за хомогенна реакция), или на интерфейсния блок (за хетерогенни реакции), доведе до образуването на нова скорост химична реакция veschestva.za приеме промяната на моларната концентрация на веществото за единица време и на единица обем на реакцията. Така без значение коя от реагентите да избере да контролира скоростта, тъй като те са свързани с една реакция уравнение. Например, моларната концентрация на реагент по време τ1



моларна концентрация показва колко мола вещество, съдържащо се в 1 литър разтвор или смес обем газ, време се измерва в секунди.
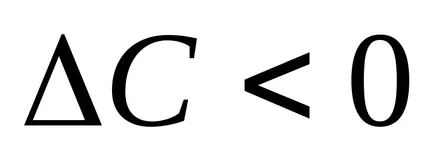
За да се изчисли скоростта на реакцията, е необходимо да се знае как да се промени концентрацията на един от реагентите за даден период от време. Колкото по-малък интервал от време, експериментално открити по-близо до истинската скорост, т. Д. Към скоростта в момента. Скоростта на реакцията е винаги положителен, така малка приема със знак минус в случая, когато изследване на промяната в концентрацията на изходния материал в реакцията (
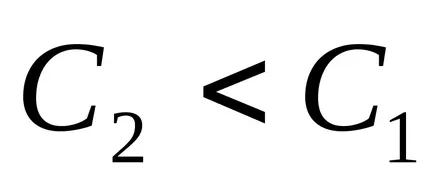
За да се определи скоростта на реакцията на процеса може да бъде избрана така, че появата на определено количество продукт се отчита визуално, например, получаване на утаяване. По този начин, интервала от време от момента на източване разтвори докато утайката е обратно пропорционална на скоростта на реакцията, така че 1 /

където

налягане (в случая на реакции, включващи газ, тъй като концентрацията варира с налягане);
от степента на смилане за реакции, включващи твърди вещества.
2.2 Зависимост на скоростта на реакция на концентрацията. Закон за действие на масата
Тази зависимост е открита две норвежки изследователи - Guldberg и Waage през 1867 година и български учени Beketovym и призова законът за действие на масата: при постоянна температура от степента на химическа реакция е право пропорционална на произведението от концентрациите на реагентите, комбинирани в една степен равен на коефициента на веществото в уравнението за реакция.
За реакционната АА + BB = тМ + Н Н закона за действието на масите има формата:
където



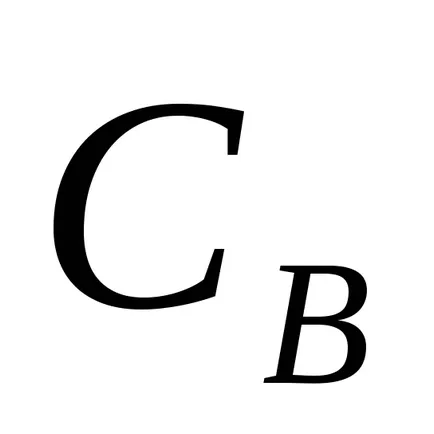
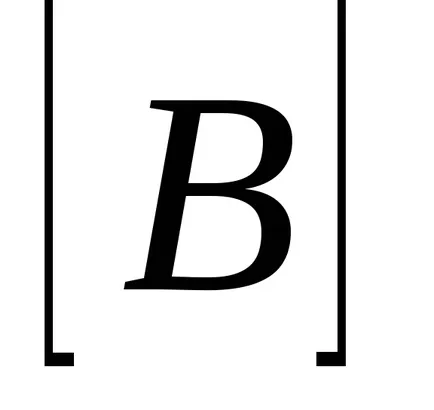
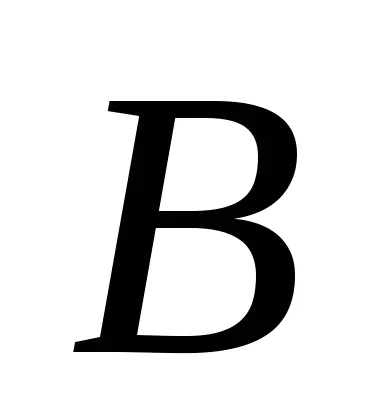

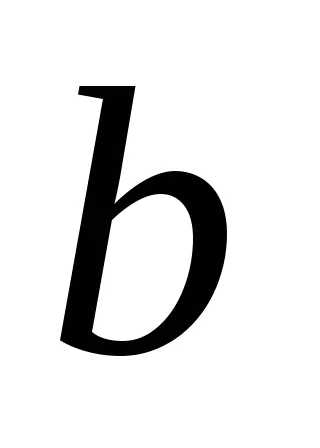
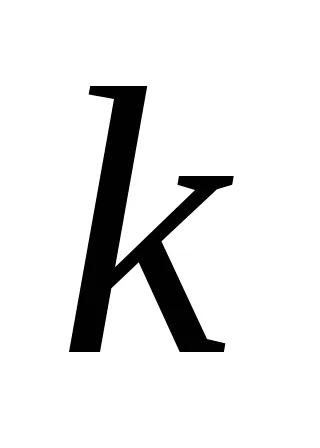
Ако приемем, че

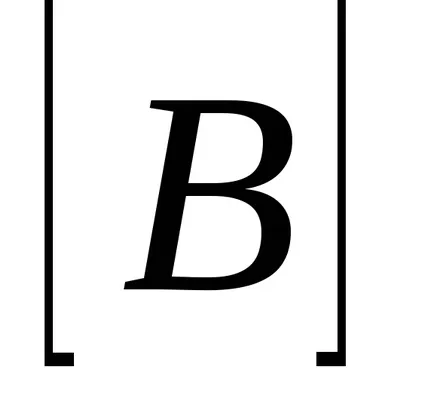
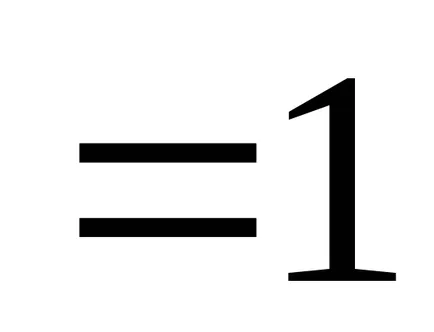
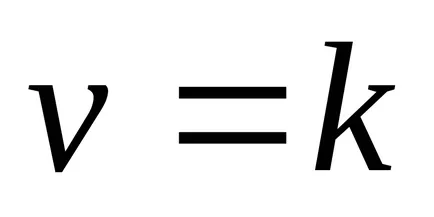
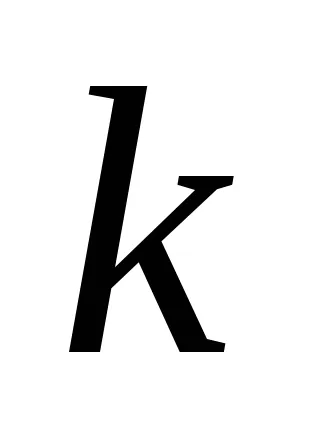
Да разгледаме пример на хомогенна химична реакция: