Химическа стоките едноосновен карбоксилна киселина
Едноосновен карбоксилна киселина
Карбоксилни киселини са съединения, притежаващи карбоксилна група -СООН а. Според броя на карбоксилни групи на карбоксилни киселини са разделени на монокарбоксилна или моноосновен (една група -СООН), дикарбоксилни или двувалентни (две групи -СООН), и т.н. В зависимост от структурата на въглеводороден радикал, карбоксилни киселини могат да бъдат алифатни (например, СН3 СООН), алициклени (С6 H3 циклохексанкарбоксилна киселина СООН) или ароматен (бензоена киселина С6 Н5 СООН).
Номенклатура.
На базирани заместване гама алифатни монокарбоксилни киселини са имената на нормални (с права верига) наситени въглеводороди. Наличието на карбоксилни групи отразява наставка -ovaya киселина, например: СН3 СООН - етанолова киселина, СН3 -СН2 -СН2-СООН, - бутанова киселина, СН3 -СН (СН3) СООН - 2-метилпропанова киселина. Имената са получени от ароматни киселини, бензоени киселини, например:
За някои карбоксилни киселини, добре установен тривиални имена: мравчена киселина - НСООН оцетна киселина - СН3 СООН, маслена киселина - СН3 СН2 СН2 -СООН.
Изомери.
Структурните изомери на монокарбоксилни киселини поради въглероден скелет разклонена (бутан и 2-метилпропанова киселина) и заместителят взаимното положение, и карбоксилна група в цикли, например три изомери метилбензоена киселина.
Методи за получаване.
1. В естествени условия, някои киселини се срещат като естери на които могат да се получат чрез хидролизиране:
R-CO-O-R '+ Н 2О <-> R-COOH + R'-OH
2. Окисляване на алдехиди и първични алкохоли. Както окислителите използвани KMnO4. K2 CR2 О7. HN03:
>>> >> Получаване на окисляване на алдехиди и първични алкохоли ">
3. Окислението на кетони води до образуването на киселини, които имат по-малко въглеродни атома на молекула от изходния кетон см. Реакциите на карбонилни съединения раздел окисление.
4. За бензоена киселина може да се използва окисление на монозаместен бензен хомолозш киселина Разтвор на калиев перманганат:
5. Използването на Гринярдов реактив по схемата:
>> Първи използване Гриняр ">
6. Хидролизни халогенни въглеводороди, съдържащи три халогенни атома при един въглероден атом:
Физични свойства.
Долна монокарбоксилна киселина (С1 - С9) са безцветна течност, по-висока алифатни и ароматни киселини - твърди вещества. Първи хомолози - мравчена, оцетна и пропионова киселина - притежават остър дразнещ мирис, смесващ се с вода във всякакво съотношение. Като хидрофобна въглеводородна част от молекулата намалява разтворимост във вода. киселина температура на кипене и по-горе точки на кипене на алкохоли и алдехиди, имащи същия брой въглеродни атоми. Това е така, защото карбоксилна киселина в течна форма асоциирани поради междумолекулни водородни връзки.
Химически свойства.
1. дисоциация киселини. Всички карбоксилни киселини, неорганични киселини като, имат киселинни свойства, оцветяване лакмус червено. Това се дължи на разпадането на киселини:
RCOOH <-> RCOO - + Н +
2. Получаване на соли. Карбоксилни киселини лесно се vstu Payuta взаимодействие с основи, основни оксиди и активни метали:
Соли на карбоксилни киселини силно хидролизира във воден разтвор като соли на слаби киселини. Минерални киселини, като силен измести карбоксилни киселини от техните соли:
СН3 COONa + HCl = CH 3 COOH + NaCl
Карбоксилни киселини са устойчиви на концентрирани минерални киселини. Изключение е мравчена киселина, която, под действието на концентрирана H2S04 разлага:
3. Получаване на функционални производни. Чрез заместване на хидроксилните групи на различни групи могат да се получат функционални производни на киселини:
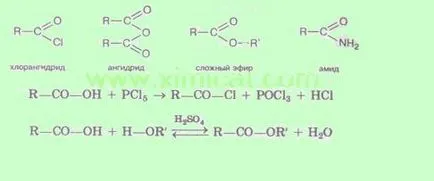
Характерно за всички тези съединения е, че те са лесно хидролизиран за образуване на киселини.
4. Под действието на халогени в присъствието на фосфорна киселина, образувана алфа-халогенирани киселини:
5. Под действието на редуциращи агенти като LiAlH4. киселина се редуцира до първични алкохоли:
6. наситен киселина с права въглеродна верига, трудно да се окисляват. Киселина за да се получи третичен въглероден атом в окисляването на хидрокси киселини:
Във всички кислород атмосфера киселини са окислени до СО2 и Н2 О.
Мравчена киселина НСООН - безцветна течност с остра миризма. Той се получава чрез нагряване на въглероден оксид (II) с прахообразен натриев хидроксид:
NaOH + CO --- 200 0 ° С, P ---> --- HCOONa H 2SO 4 ---> НСООН
Мравчена киселина има редица функции:
а) се разгражда под действието на дехидратиращи агенти за образуване на СО;
б) това е намаляване на реакция и дава "сребро огледало":
В допълнение, мравчена киселина се окислява с хлор:
Оцетна киселина СН3 СООН е широко разпространен в природата, образувани в процес на ферментация, гниене, skisanii вино, мляко, както и чрез окисление на много органични вещества. Безводната оцетна киселина има точка на топене + 16,6 ° С, неговите кристали са прозрачни като лед, така че тя се нарича ледена оцетна киселина. В промишлеността, оцетна киселина се получава чрез каталитично окисление на бутан с кислорода от въздуха при 200 ° С:
Оцетна киселина се смесва във всички отношения с вода, алкохол, етер, бензен, е устойчив на оксиданти. Сред мастни киселини заемат специално място висши мастни киселини - палмитинова СН3 - (СН2) 14 СООН стеаринова и СН3 - (СН2) 16 -СООН. Голям брой на висши мастни киселини, получени чрез окисляване на парафин. Окислението се извършва при въздух барботиране през стопения парафин в присъствието на манган оксид при 100 ° С