Геометрията на молекулата като ключ към разбирането на свойствата на веществата
Клас 9 "м", Сфакс училище № 197 в Екатеринбург
Чиликова Светлана Алексеевна
Геометрията на молекулите е пряко свързана със структурата на атом. Понятието пространствената структура на молекулите на веществата важни за химия по принцип като наука, която изучава вещества, техните свойства, методи за получаване и използване.
В допълнение, представителството на пространствената структура на молекулите се развива абстрактно и пространствено мислене, което е от особено значение в контекста на съвременната наука и технологично развитие.
За съжаление, тези неща или се показва за рамки на учебната програма, или да се изследва е дадено малко време.
Разбиране на връзката между молекулярна структура и свойства на веществата логика определя отношенията външно съвсем различни явления, и помага да се образуват научно мислене.
В тази работа, са се опитали да се анализира връзката между пространствената структура на водните молекули и метана и техните физични и химични свойства.
Вода - вещество, чиято основна структурна единица е молекула на Н2 О. В съответствие със съвременните концепции на атомната структура, във втората - външната - слой електронен кислороден атом е шест електрони, електронна конфигурация означени 1Р 2 2p 4. Въз основа на хибридизация на атомната орбитали теория и метод валентността облигации, двойка несдвоен валентност 2-р-електрон на кислородния атом в състояние на SP 3 хибридизация взаимодейства с всеки от 1s-електрон на два водородни атоми за образуване на водна молекула. Другите две SP 3 -Hybrid орбитите на кислородния атом има две двойки електрони, които не участват в образуване на връзка. Всичките четири двойки електрони заемат определена област в пространството около централната кислородния атом в молекулата. Поради взаимното електростатично отблъскване между свързване и необвързващи електронни двойки, една молекула вода се симетрична форма. Фиг. 1 е диаграма на припокриването на електрони орбитали на кислород и водородни атоми в образуването на молекула вода.
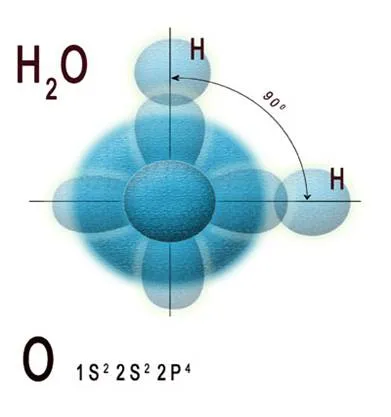
Фигура 1. Схема на припокриването на електронни орбити на атома на водорода и кислорода в молекула вода
Молекулата на вода има структура, която прилича на равнобедрен триъгълник, на върха на която е кислороден атом, и в долната част - два водородни атома. Ъгълът на скосяване е 104 ° 27 ', а дължината страна - 0.096 пМ. Тези параметри са свързани с хипотетично равновесно състояние на водните молекули без неговите трептения и ротации [1]. Схематично, структурата на молекула вода е изобразена на фигура 2.
Молекулата на водата е дипол с положително и отрицателно заредени полюсите. Ако приемем, че е възможно да се постави в електрическо поле на една молекула вода не е свързан с други молекули, след което тя ще се превърне отрицателните полюси в посока на положителния електрод и положителните клеми - към отрицателно.
Фигура 2. Диаграма на молекула вода
Ако се свързвате с прави линии на епицентъра на положителните и отрицателните заряди на молекулата на водата, можете да получите обем геометрична фигура - редовно тетраедър.
Тъй като молекулата на водата е асиметричен, на центъра на тежестта на положителните и отрицателните заряди, не съвпадат. Водните молекули имат два полюса - положителни и отрицателни. Те са като магнит, създаване на поле за молекулно сила. Такива молекули са наречени полярен или диполи (Фиг. 3) [2].
Фигура 3. Насипни аранжимент верига хибридни орбитали в молекулата на водата
Водородни връзки като форма на асоцииране между електроотрицателна кислороден атом на една молекула от водородни атоми и други молекули, отговорни за много от уникалните свойства на вода. Енергията на водородна връзка значително по-малко енергия обикновено ковалентни връзки (по-малко от 40 кДж / мол). Въпреки това, тази енергия е достатъчна да причини свързване на молекули, т.е., тяхната връзка в димери или полимери [2]. От една молекула вода може да се образува до четири класически водородни връзки със съседните молекули, че е броят на водородните връзки обяснява необичайно висок топлинен капацитет на вода, относително висока точка на кипене, висок вискозитет и повърхностно напрежение.
От вида на структури в природата на основата е шестоъгълна (хекс) структура, където шест водни молекули (тетраедри) са комбинирани в един пръстен (фиг. 4 б) [5].
Ние се опитваме да анализираме връзката между свойствата на водата и нейните структурни елементи на молекулите. Таблица 1 показва резултатите от сравнението. Както се вижда от таблицата, че водата има аномални стойности на физичните свойства, което е най-вероятно в резултат на характеристиките на структурата на материята.
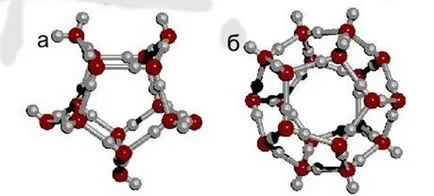
Фигура 4. клъстери вода
Физични свойства на вода [4].
Да разгледаме структурата на друго вещество. Метан - простият въглеводород, чиято химична формула е СН4. Като молекула вода, по същество се състои от един елемент, свързан с голям брой водородни атоми. Но сходство състав на метан и водни молекули, свойствата на тези материали са различни.
Нека да се опита да намери обяснение за този факт в особеностите на структурата на метан молекула [3].
въглероден атом във външната електрон слой 4 има електрон, електрон формула 1ssp 2. Изглежда, че тук са изправени пред конфликт - са само несдвоен електрон 2 р, и S-електрони са сдвоени, но всички химични връзки С-H в молекулата метан са еднакви по дължина и енергия. Тъй като химическите връзки, обикновено монтирани за сметка на несдвоен електрони метан молекула трябва да бъдат с формула СН2. което не е вярно. Това противоречие се елиминира чрез третиране на образуването на химически връзки в резултат на хибридизираните електронни орбитите.
Когато въглеродният атом, реагира с водородните атоми, свързани S-електрони външната слой се отделя, един от тях заема място на р-орбитала и движението образува облак под формата на обем осем перпендикулярно по отношение на облаци от две други п-електрони. Atom в възбудено състояние, и електрон формула тя може да бъде записано като една 1Р 2P 3.
Сега всичките четири валентен електрон са несвоен и могат да образуват четири химични връзки.
В този случай, нов противоречие. Теоретично, три р-електрона трябва да образува химически връзки с три водородни атома във взаимно перпендикулярни посоки, т.е.. Е. ъгъл от 90 °, а четвъртият водороден атом може да бъде свързан в произволна посока, тъй като S-електронен облак е сферична. Такива връзки очевидно ще се различават по своите свойства. Междувременно, известно е, че всички С-Н връзки в молекулата на метан са идентични и са разположени под ъгъл от 109 ° 28 '. За да се обясни това противоречие прави концепцията на хибридизация на електрона орбитите въглеродни атоми - смесване и изравняване на орбитален форма и енергия (Фигура 5.).
Фигура 5. Хибридизацията на електрони орбитали въглеродни атома в молекулата на метан
Така, метан четири хибридни орбитали на въглеродните атоми в пространството образуват геометрична фигура тетраедър, ъглите между осите на C-H облигации са равни 109 ° 28 '. Такова валентно състояние се нарича въглеродни атома SP 3 -gibpidizatsiya. Пространственото подреждане на атомите в молекулата на метан може да се докаже с помощта четиристенните и sharosterzhnevyh модели. Фигура 6 показва модела sharosterzhnevye метан молекула. Както се вижда от фигурата, моделът се вписва в тетраедър на метан молекула [7].
Фигура 6. Sharosterzhnevye модел метан молекула
Таблица 2 показва физичните свойства на метан. Както се вижда от представените данни, не-полярността на молекулата на метан е причината за слаби междумолекулни връзки, като следствие - температури ниска точка на кипене и топене.
Физични свойства на метан.
Сравняване на структурата на молекулите на вода и метан и техните свойства, е възможно да се направят някои заключения.
Молекулата на метан, както и молекула вода, образува пространство в тетраедър. Въпреки това, за разлика от водните молекули метан молекула не полярност. Хибридни орбитали външен слой електрон въглерода блокирани S- орбитали на водородните атоми и четирите химични връзки еквивалентни [6].
Полярността на водните молекули определя възможността за образуване на водородни връзки между водните молекули, което води до специфични физични и химични свойства на вода. Всяка молекула на вода като малък магнит привлича поради образуването на водородни мостове четири молекули. Тъй като водата се изпарява унищожаване на многобройни водородни връзки изисква много енергия, и като резултат - висока стойност на повърхностното напрежение. висока точка на кипене е следствие на висока специфична топлина на изпарение, който от своя страна се дължи на неравномерното разпределение на електронната плътност в молекулата на водата.
метан молекули са неполярни и относително слабо взаимодействат един с друг. Поради това течен метан се изпарява при много ниски температури. Метан молекули не могат да се събират стабилна структура и е газообразен метан. Неполярни метан молекули също обяснява факта, че метанът е слаб разтворител.
По този начин, ние заключаваме, че това е структурата на метан и водни молекули води до разлика в техните свойства и следователно може да се приеме, че свойствата на всяко вещество е в пряка зависимост от структурата на молекулите. Разбиране на теоретичните основи на структурата на материята е ключът към разбирането на свойствата, разработването на методи за получаване и използване на вещества от съвременните учени.
2.Gillespi P. Геометрията на молекулите. София, Акад. "Мир", 1975 г., 282 стр.