Формалдехид от метанол - химична справка 21
Мравчена алдехид. или формалдехид, СН2 = 0 - газ с остър неприятна миризма, е силно разтворим във вода. Антисептик, както и дъбилни свойства. Воден разтвор на формалдехид (обикновено 40% (тегл.)), Наречен formalinom-, той е широко използван за дезинфекция, запазване на анатомични екземпляри. третиране на семена преди сеитба и т. р. Значителни количества формалдехид се използват за фенол-формалдехидни смоли (вж. Sec. 31.1.1). Получава се от метилов алкохол, за да формалдехид чрез каталитично окисление на атмосферен кислород или му от дехидрогениране (водород абстракция) [c.575]
Леярската тръба 2.3 мл метилов алкохол. потапя нагрява пламък окисляване горелката парче медни стружки и затваряне на запушалката. След 2 минути 2,3 мл прилив безцветни фуксин разтвор на киселина. След затваряне на запушалката на флакона, поставете го в schtatyv. След няколко минути, разтворът постепенно боядисани в пурпурен цвят, показващ присъствието на алдехид. Добави уравнение реакция образуване формалдехид метилов алкохол. [C.229]
Носителят може да бъде под формата на груби или фини маса зърно, може също да бъде колоиден. Предполага се, че носителят е каталитично инертен материал срещу реагиращи компоненти. Реакциите на окисляване. например при получаването на формалдехид от метанол. препоръчва да се използва като не-окисление носител материал (пемза, калциниран глина, или инфузорна пръст). Тъй като алуминиев оксид в тази реакция е катализатор Алундум в този случай е най-подходящ носител. Когато катализаторът се използва в носител от силициев диоксид-съдържащ. за да се избегне нагряване до температура, при която може да образува катализатор силикати. Ако каталитичната реакция изисква температура. тогава магнезиев оксид. алуминий. Природен боксит, вар или калциев карбонат може лесно да се заменя etst носител. Това показва, че някои свойства на носителя, като например размера на порите и капилярите, адсорбция капацитет, способността за обмен на съставките, устойчивост на механично износване и колоиден характер (пластичност, тиксотропия, флокулация, коагулация и т.н.) трябва да се разглежда във връзка с възможностите за приложение (депозити) катализатор или да ги импрегниране. [C.475]
Каталитичните реакции. в която алуминиев mszhet бъде активна, тя се заменя Алундум, т. е. korundsd изкуствено получено. Snalling [378] каза Алундум подходящ носител за катализатор мед в получаването на формалдехид от метанол. Punnet [301] препоръчва използването на Алундум като носител за пентоксид ванадий в получаване на малеинов анхидрид. В някои случаи активността на никел. като дехидриране катализатор може да намали отлагането на метала върху алуминиев оксид, използван като носител [329, 430] В този случай, катализаторът в неговото действие е подобен на паладий и платина. Zelinsky и Komarevsky [430] катализатор, получен както следва: [c.500]
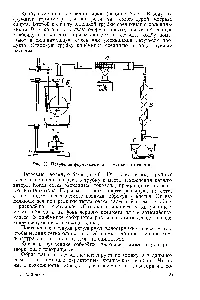
Фиг. 5 показва процес схема на производство на формалдехид от метанол [91] в съветската катализатор, съдържащ 77-81% и 19-23% MoOz ReaOz, експлоатационен живот е 6-12 месеца. Мощност настройка 40 хиляди. T 40% воден разтвор на формалдехид годишно. Смес, съдържаща 6,5% (об.) И СН3ОН 11% (об.) 2 (например въздух) се подава в тръбния част на реактора 2, изпълнена с катализатор. тръби метил алкохол се превръща почти изцяло. и топлината, освободена се отстранява чрез преминаване през масло яке реактор. Част от маслото се нагрява (10%) се охлажда в един котел-утилизатор. което позволява да се поддържа желаната температура масло на входа на тръбата пространство на реактора. Газовият поток на изхода на тръбната част на реактора преминава през адиабатно катализаторен слой. където окисляването на нереагирал алкохол. Тръбната част на температурата на реактора се поддържа при 360-370 ° С и в адиабатно 380-390 ° С [C.54]
Това се основава на техническото получаване на формалдехид от метанол. Смес от метанол пара и въздух се пропуска през нагрява мед или сребро мрежа под каталитичното действие на нагрят метален водород извличане на случи. който се окислява с кислород и по този начин се отстранява от реакционната кръг. Тъй като това се отделя топлина. метална мрежа изток aetsya напрегната през цялото време. Нагряването е необходимо само, за да се предизвика реакция. Беше направено подробно проучване на този процес. EI р л о и м В същото така наречените устройства базирани glyh формалин крушки. Над обикновен дух лампа. изпълнен с метанол. суспендира Спирално навита платина тел и лек алкохол червено-гореща платина проводник. След това гасенето на пожара, но алкохол продължава да се изпари, като кратко разстояние от фитила свети платина проводник. Следователно, жицата е заобиколен от смес от метанол пара и въздух. При контакт с нагрята платина окисление настъпва метилов алкохол, за да се образува формалдехид. и платина спирала. въпреки липсата на пламъка е червено-горещо, както в окисляване на метилов алкохол. или, по-точно, водородът, който се разцепва от метилов алкохол, под каталитичното влияние на платина, генерира топлина. Около крушка простира миризма на формалдехид. Тъй като формалдехид (формалин фармацевтичната му име) се използва за дезинфекция, такива формалин крушки в старите дни, когато формалин е малко достъпно, поднесени с лек дезинфекция дома. [C.140]
Виж страница, която се споменава терминът формалдехид от метанол. [C.486] [c.201] [c.61] [c.482] [c.486] Chemistry петролни въглеводороди и техни производни е 1.2 (0) - [c.852. c.930. c.938]