Азотът ръководство
Азот - един от най-необходимите за растителна химичен елемент. Представете навсякъде в свободен или свързан държавата. Азотни торове, произведени в различни форми и се използват за основна и преди посяването - повърхност, така и торене. Само 1% от почвата азот е в лесно смилаеми растения от минерални форми, така че използването на азотни торове - важно условие за поддържане и увеличаване на плодородието на земеделска земя.
Много добре известни научни открития са направени от двама изследователи, които са работили независимо една от друга, както и такива случаи са доста многобройни. Въпреки това, по отношение на откриването на елемента на азот, е необходимо да се дава приоритет на един от трите известни химици. Всички от тях са идентифицирани азот от въздуха, като се използва малко по-различни методи на подготовка, и го направих почти по същото време, в края на ХVIII век.
Що се отнася до името на елемента, той предложил на французина Antuan Лоран Lavuaze, а срокът е напълно отразява същността на наблюденията на трите учени, които първи изследвани свойствата му. Думата се състои от две части: ". Живот" представката "а" означава да се отрече, а коренът на думата "Зоя", което в превод от гръцки Мъртвия без животворната - че "азот" означава в семантичен превод.
Известният учен и той е правилно и грешно в същото време. Нека азотен газ и не поддържа дишане, обаче, той образува различни органични вещества, които са изградени от компоненти на живи клетки, предимно протеинова молекула. Той определя абсолютната задължителността на азот в продължение на живота на Земята и което го прави един от основните макро-жива клетка, заедно с кислород, водород и въглерод. [7]


Физични и химични свойства
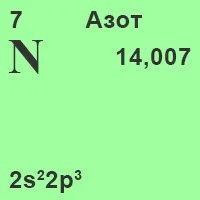
Азот - химичен елемент от група V на система на Менделеев. Атомна брой - 7 атомна маса - 14,0067. Природен азот се състои от две стабилни изотопи. [6]
Азот - безцветен газ, без мирис.
- Точка на кипене - 195,80 ° С,
- Точка на топене - 210,00 ° С
Слабо разтворим във вода, по-лек от въздуха. Молекулно азот химически maloaktiven. При стайна температура, тя взаимодейства само с литий. При нагряване, той реагира с калций, магнезий, титан. взаимодействие с реакцията на водород се извършва при висока температура, високо налягане и в присъствието на катализатор, с кислород - с температура 3000-4000 ° С
Най-високата стойност на съединенията с водород е амоняк - газ без цвят, с характерна миризма на амоняк.
С представлява серия от кислородни, азотни оксиди: азотен оксид N2 О, NO, азотен оксид, азотен диоксид NO2. азотен анхидрид 2O 3. [3]
Свързаната азотът се среща навсякъде: във въздуха, водите на реките, моретата и океаните. В кората образува три основни вида минерали, които се различават в техните редици йони, - CN -. NO3 - и NH4 +.
Големи находища на натриев нитрат NaNO3 са в Чили, на брега на Тихия океан. Това е уникален в световен голяма област, съдържаща неорганичен азот съединение.

Цикълът на азот в природата
Sod-подзолисти почвата прекалено овлажнен
Общ азот в запасите от повърхностния слой на почвата може да достигне до 15 тона на хектар. [2]
Торфено блато почви

Азот фиксиране коренни възли на бобови растения
Производство на азотни торове въз основа на получаване на амоняк от молекулярен водород и азот от въздуха. Последните могат да служат като източник на природен газ, коксов газ, или масло.
Азотни торове са разделени на шест групи:
източник на азот за растенията са органични торове:
Оборският тор върху рогозка
може да съдържа общ азот 0,45 - 0,83% протеин азот 0,28 - 0,35% от амоняк азот 0,14 - 0,20%. В polupereprevshem отпадъци тор съдържа общ азот от 0.50 - 0.86%, амонячния азот - 0,07 - 0,15%.
суспензия
- най-ценни азотосъдържащи органични съединения калиев тор. Тя се отнася до живите. Като цяло, той съдържа от 0,26 до 0,39% азот.
Екскременти от птици. Той съдържа голямо количество азот. В зависимост от вида на птици и фуражи, се подава към тях, процентът на азот в постеля на домашни птици в границите от 0.5 до 1.6%. По-богат на азот отпадъци птичи тор. В зависимост от вида на отпадъци, че включва от 1.6 до 2.22% азот. [4]
Методи за прилагане на азотни торове
Натриев нитрат (натриев нитрат, чилийски нитрат) се използва универсално в различни почви и култури за основните и преди посяването - повърхност, така и торене. [8]
Калциев нитрат за повечето растения е еквивалентно на натриев нитрат. Изключение - захарно цвекло и зеленчуци корен. В този случай тора по-малко ефективно. [8]
амониев азот
торове (амониев сулфат, амониев хлорид) - ефективност зависи от степента на киселинност и буфериращи почвата и биологични характеристики оплодена култури. Той се използва за основната и посяването - повърхностни, така и торене. [8]
Амониев нитрат торове (амониев нитрат)
- универсален тор. Може да се използва при всяка култура, във всички почви преди засаждане, като тор за посев и подхранване. Най-подходящо да се използва за наторяване на зимните култури, пасища и hayfields. [1]
Амоняк торове (безводен амоняк. Амонячна вода)
използван като основен предсеитбено тора за всички култури. Се извършва през пролетта, преди засаждане, и есен. [1]
Амидни торове (урея)
за предпочитане се прилага едновременно с незабавно включване в предпосевно третиране на почвата за пролетни култури, царевица. Тя не се препоръчва да се прилага в студено време в началото на пролетта. [1]
Карбамид-амониев нитрат торове, UAN (карбамид амониев нитрат)
азотни торове бавно освобождаване
направени във високи дози на всеки две до три години. доставка на азот власт на първия и следващите култури. [8]
Ефект на азот
Картофи, царевица, сено ливадни треви, корени на захарно цвекло, лен и други и / култури
рационалното използване на азотни торове се осигури значително увеличаване на производителността и подобряване на качеството на продукта.
захарно цвекло
- повишено съдържание на захар. [8]