Алкално-алумосиликат стъкло
Алкално-алумосиликат стъкло. - раздел Chemistry, химическата връзка в очила в съответствие с теорията на структурната роля алуминий електрон-S (Al) в чашата Идентичен на неговата роля в кристална.
Структурната ролята на алуминий (Al) в стъклото е идентичен с неговата роля в кристални алуминосиликати, т.е. А1 3+ катиони могат да бъдат във четворна или шест-кратна координация на кислород тетраедри и форма координация тип А104 (тетраедри) и А106 (осмоъгълниците).
Състоянието на съществуване на алуминий в даден координира Сион състояние в силикатни стъкла е съотношението между концентрацията на алкален (или алкалоземен) А12 оксиди и окис 03. В съотношения М2 0 / A12 03> 1 А1 3+ йони, присъстващи в стъклото в четиристенен среда. Трябва да се отбележи, че групирането на [А104] 5 в силикатни стъкла не съществува самостоятелно. Той е стабилен само ако близко тетраедър [А104] 5- намира алкален метален йон, такъв като натрий. Стабилен в този случай не е просто групиране [А104] 5- група от атоми, [(А104) 5-Na +] 4-. където натриев йон не е Con-свързан към всеки конкретен кислороден атом, и е локализиран на тетраедъра [А104] 5- частично компенсиране на отрицателен заряд на анионни групи.
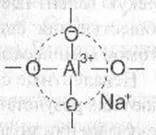
Атомите на кислород при върховете на тетраедър А104 в този случай са мостови и могат да участват в образуването на химически връзки с силиций-кислород тетраедри. Както в кристален силикат четиристенен алуминиев групата могат, заедно с SiO4 тетраедрите. участва в изграждането на структурна стъклена рамка, се обединяват с тях върховете. Форма смесен алумо-силикат мрежа.
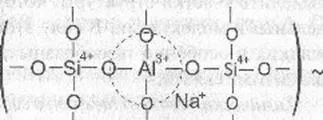
Когато се прилага в алкален алуминиев силикат стъкло повишава степента на структурна връзка с мрежата, като тя е вградена в клетката на силиций-кислород и заедно с това промяна на структурната роля на алкален компонент.
Най-благоприятни условия за isomorphically заменят депозитите на силициеви йони до алуминиеви йони се генерират в присъствие на ново Catió № +. К +. Са2 +.
Наличието на алуминий в очила в шесткратно нагънат координация е най-вероятно в алкални свободни и ниско алкални състави с вас, изрази киселинен характер. Алкалоземни катиони малък радиус на Be 2+. Mg2 + помогне за стабилизирането алуминиев стъкло, което модификатор.
9.Valentno-химическо описание на структурата на стъкло.
Химическа връзка между атоми се появява в резултат на електростатично (Кулон) взаимодействие на електрони и атомни ядра.
Химични връзки в веществата могат да бъдат: валентност и ковалентна. Valence връзки шум-кабини резултат преразпределение на електронната плътност в системата от атоми, които участват в химическата реакция. Разграничаване йонни, ковалентни, донор-акцептор сменяем, метални-тират валентните връзки, които се различават един от друг за степента на облигации obschestvleniya двойки електрони атоми или групи от атоми на химическо съединение.
Nonvalent шум-кабина комуникация чрез електростатично взаимодействие между MO-молекули или молекулно групи вещество. Образование зададена nonvalence връзки не е придружено от прехвърляне на електрони, но поради индуциране или ориентировъчна дисперсия Nym взаимодействие молекули или молекулни единици.
Стъклото като в кристални твърди вещества, не е възможно да се разпределят части от структури, които могат да се разглеждат отделно от-молекули. Поради тази причина, в твърди вещества, за разлика от течност и газ, по-специално, доминира действието на силни валентните връзки.
10. химичната връзка в очила, съгласно теорията на електрон-S.
Според класическата теория на електрони, химичната връзка в силика стъкло е за предпочитане ковалентна (степен на ionicity 50%). два типа йонни-ковалентни връзки могат да бъдат разграничени в двоични очила алкални силикатни тип Me2 0-SiO2: предимно ковалентни атома във вериги
или повече йонни връзки между катионите на алкални и анионни скелет, т.е. тип връзка -Me-О-Si-.
Е степента на йонната характер - covalency на Si-O. Ме-О не желае да създаде постоянен NE-за всички видове стъкло, в зависимост от състава на стъклото като цяло.
Всички теми на този раздел:
Историята на развитието на стъкло на решения.
История художник първо и Инд. Стъкларството производство може да бъде условно разделена на пистата. периоди: период 1: 4-3e хилядолетие пр.Хр. В примитивните общества претопи първите опити
Стъкло, стъкловиден.
В природата, всички вещества и техники могат да бъдат sost: плазма, газ, течни и твърди. Твърдите вещества могат да бъдат кристални. или общата структура. Специален случай на аморфно състояние-STE
В структурата на стъклото.
Идеята на стъклото като сложна система изложени и научно обоснована DI Менделеев. Според DI Менделеев, стъкло не е определено химическо съединение счита от много химици първите полове
Crystal-химично описание на структурата на стъкло.
основа концепцията на това разкритие са ниски и далечни разстояния за в структурата на вещества. Малък обсег на ред като цяло OZNA-chaet правилното място на отделните атоми спрямо Fi
Kvartsevaoe стъкло.
Основната структурна единица на кварцово стъкло е силиций-кислород тетраедри [SiO4] 4-. Известни гео метрични параметри групиране [SiO4] 4-: Si-O разстояние, равно-но 0
Валенсия теория връзка и структура на очила.
Тази теория OAPC-желаят да се създаде обяснява образуването на фокусни групи пространствени (polyhedra) въз основа на структурните характеристики на атомите отчита енергийните характеристики на външните орбитите
Band теория.
Структурните характеристики на външните зони и естеството на тяхната електрони пълнене дава възможност за класифициране на веществото в изолат-RY, полупроводници и проводници, както и увереност да покаже predska оптични електрически
Вискозитет.
Вискозитет - най-важната характеристика и предопределящи готвене процеси произвеждат стъкло, отгряване и охлаждане. Според закона на Нютон с един слой от течни менти относно друг възкресени
Искате ли да получавате по имейл последните новини?
