01 февруари


1.4.7. Хидролиза соли. Сряда водни разтвори: кисели, неутрални и алкални.
Хидролиза - това взаимодействие с вода вещества, като в резултат на което варира разтвор за транспортиране.
Катиони и аниони на слаби електролити, способни да реагират с вода за образуване на стабилни malodissotsiiruemyh съединения или йони, като по този начин се променя разтвор за транспортиране. Формула вода в уравнения хидролиза обикновено се записва под формата на Н-OH. При взаимодействие с вода, катиони на слаби основи отбити хидроксилни йони вода и излишък от Н + в разтвора. Среден става киселинен разтвор. Анионите на слаби киселини привличат вода от Н +. и реакционната среда става алкална.
В неорганична химия често трябва да се справят със сол хидролиза, т.е. взаимодействие на солта с обмен на йони с водни молекули в процеса на разтваряне. 4 Разграничаване хидролиза изпълнение.
1. образуваната сол със силна основа и силна киселина.
Такава сол хидролиза на практика не е изложен. Когато това равновесие дисоциация на вода в присъствието на сол йони едва разделени, така че рН = 7, средата е неутрален.
Na + + Н 2О

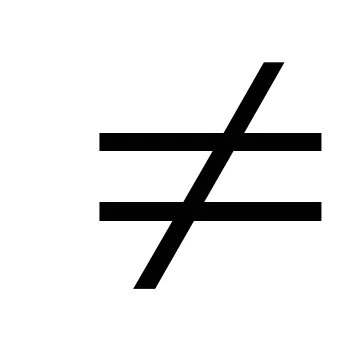
2. Ако солта, образувана от силна основа катион и анион на слаба киселина, хидролизата на аниона.
Na2 CO3 + HOH NaHCO 3 + NaOH
Тъй като йоните ОН натрупват в разтвор -. алкално рН> 7 - среда.
3. Ако солта, образувана от катион и слаба основа анион на силна киселина, хидролизата е катион.
Си2 + + HOH CuOH + + Н +
SuCl2 + HOH CuOHCl + HCl
Тъй като в разтвора на Н + йони се натрупват. е кисела, рН<7.
4. Солта, образувана от катион и анион на слаба основа на слаба киселина, и се хидролизира чрез катион и анион.
СН3 COONH4 + HOH NH4 OH + CH3 СООН
СН3 СОО - +

Разтвори на такива соли са или слабо киселина или слабо алкална среда, т.е. рН около 7. Реакционната среда зависи от съотношението на дисоциационните константи на киселина и основа. Хидролиза соли, образувани много слаба киселина и основа е практически необратимо. Това е главно сулфиди и карбонати на алуминий, хром и желязо.
Al2 S3 + 3HOH 2AL (ОН) 3 + 3H2 S
При определяне разтвор среда сол трябва да се счита, че околната среда се определя от силен компонент разтвор. Ако се образува сол на киселина, която е силно електролит, киселият разтвор за транспортиране. Ако основата е силна електролит, а след това - алкална.